Césium 137 - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Le césium 137, noté 137Cs, est l'un des 39 isotopes connus du césium (élément qui a le plus grand nombre d'isotope après le francium. C'est l’isotope du césium dont le nombre de masse est égal à 137 : son noyau atomique compte 55 protons et 82 neutrons avec un spin pour une masse atomique de 136,9070835 g/mol.
Il est caractérisé par un défaut de masse de 86 551 145 ± 2 985 eV/c2 et une énergie de liaison nucléaire de 1 149 292 932 ± 2 991 eV.
Origine
C’est l'un des nombreux produits de fission de l'uranium) et le plus connu, pour avoir été utilisé dans les études hydrologiques et écologique suite à une contamination générale de l'atmosphère induite, à partir de 1945, par l'utilisation des bombes atomiques et des essais nucléaires (puis l'accident de Tchernobyl), et, dans une moindre mesure, à cause des rejets de centrales nucléaires ou de sites de retraitement, stockage, etc.
Son suivi a par exemple permis de mesurer à quelle vitesse l'eau des nappe se renouvelait, la cinétique environnementale du césium (notamment dans la chaîne alimentaire) ou si une grotte était ou non isolée du monde extérieur.
Radioactivité
Un gramme de césium 137 pur présente une radioactivité de 3,26 TBq.
Le césium 137 se désintègre en baryum 137 (de courte durée produit de la dégradation), puis en une forme de baryum non-radioactif.
Dans l'environnement, on le trouve rarement seul. Les déchets radioactifs, ou les retombées d'essais nucléaires atmosphériques ou de l'accident de Tchernobyl peuvent également contenir du césium 135 (à très longue période radioactive), du césium 134 (période de 2 ans), mais le césium 137 (période de 30 ans) compose l'essentiel des formes du césium libérées à ces occasions.
Apparence
Quand il est pur, il se présente comme un métal alcalin argent-doré.
Son point de fusion est assez proche de la température ambiante (CATP) pour qu'il soit possible de l'obtenir à l'état liquide à cette température grâce à la surfusion (comme pour le gallium et rubidium)
Sources de contamination
C’est un produit de fission de l’uranium et, comme tel, des quantités plus ou moins importantes de cet isotope ont été relâchées dans l’atmosphère d'abord dans les années 1940 et 1950 lors des essais nucléaires à l’air libre, puis lors d’accidents nucléaires (Voir la Liste des accidents nucléaires). La dernière contamination générale de la biosphère a été induite par la Tchernobyl, le 26 avril 1986 qui reste aujourd’hui la principale contamination radioactive de la zone interdite et de certaines zones contaminées par le passage du nuage.
Désintégration
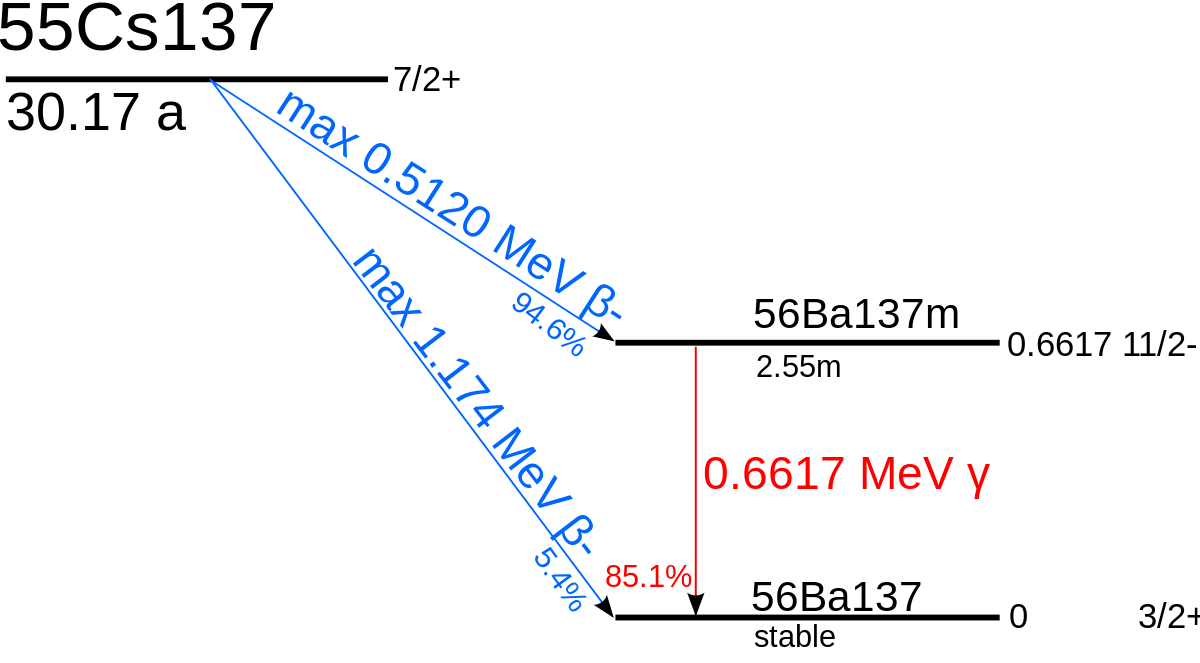
Dans 94,6 % des cas, il donne l’isomère 137mBa du baryum 137 par désintégration β- avec une énergie de désintégration de 512 000 eV et une période radioactive de 30,07 ans, lequel retombe à son état fondamental par transition isomérique émettant un rayonnement γ de 661 700 eV avec une période de 2,552 minutes :
Dans les 5,4 % des cas restants, il se désintègre directement en 137Ba avec une énergie de désintégration de 1 174 000 eV.
Le rayonnement γ émis par le 137mBa peut être utilisé à des fins médicales ou industrielles, par exemple pour l’irradiation des aliments, mais le césium 137 n’est en fait que très peu utilisé en raison de son instabilité chimique bien plus grande que celle du cobalt 60, isotope bien meilleur pour ce type d’applications car chimiquement plus simple à contrôler et émettant un rayonnement plus puissant. On le trouve dans certains appareils de mesure de densité ou d’humidité, des débitmètres et divers détecteurs.
![\mathrm{^{137}_{\ 55}Cs\ \xrightarrow[30,07\ ans]{\beta^-\ 512,0\ keV}\ ^{137m}_{\ \ \ 56}Ba\ \xrightarrow [2,552\ min] {\gamma\ 661,7\ keV}\ ^{137}_{\ 56}Ba}](https://static.techno-science.net/illustration/Definitions/autres/0/009fb48182ed49b16460f14bcba78d5e_8048558aebdefaf15d390b666af4326a.png)