Chlorure de zinc - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorure de zinc | |||
|---|---|---|---|

| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | solide de forme variable, hygroscopique et blanc | ||
| Propriétés chimiques | |||
| Formule brute | ZnCl2 | ||
| Masse molaire | 136,29 ± 0,02 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 290 °C | ||
| T° ébullition | 732 °C | ||
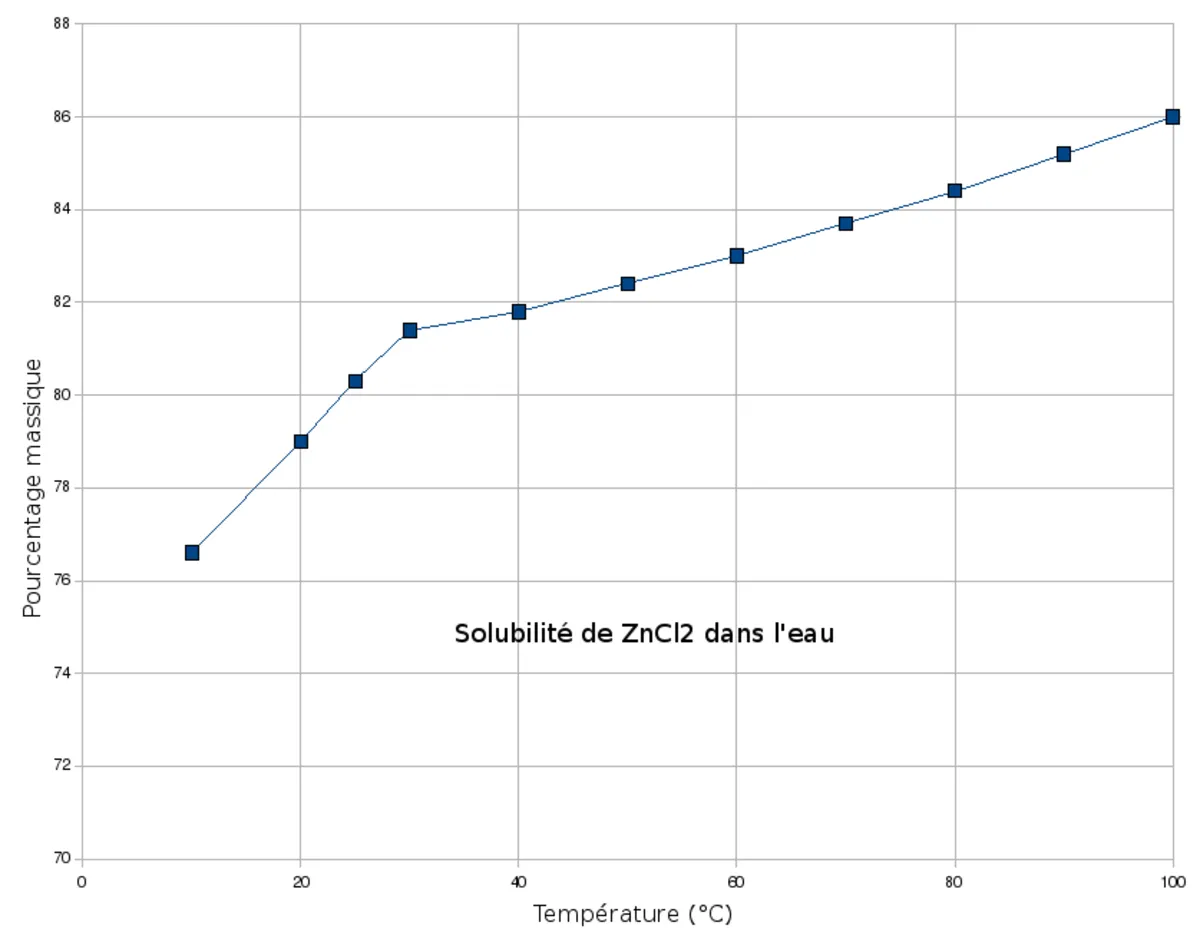
| Solubilité | dans l'eau à 25 °C : très bonne (4 320 g·l-1), 100/100 ml eau (12,5 °C,eau) | ||
| Masse volumique | 2,9 g·cm-3 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 22, 34, 50/53, | |||
| Phrases S : (1/2), 26, 36/37/39, 45, 60, 61, | |||
| | |||
| |||
| | |||

| |||
| | |||


Danger | |||
| | |||
Le chlorure de zinc est un sel de zinc de formule chimique ZnCl2. C'est un solide blanc ou incolore, extrêmement hygroscopique.
Quatre structures cristallines différentes ont été observées, mais seul la forme δ (hexagonal compact) peut se former lorsque le composé est pur et anhydre. S'il subit une trempe rapide, ZnCl2 peut être obtenu sous forme vitreuse.
Les solutions aqueuses concentrées de chlorure de zinc ont la propriété de dissoudre l'amidon, la soie et la cellulose. Elles ne peuvent donc pas être filtrées à travers du papier de filtration standard.
Le chlorure de zinc a de nombreuses applications dans l'industrie textile, la métallurgie et la synthèse chimique.
Propriétés chimiques
Le chlorure de zinc est un sel ionique, qui possède tout de même un caractère covalent qui est mis en évidence par sa température de fusion relativement basse (275 °C) et sa solubilité élevée dans des solvants comme l'éther. Il se comporte comme un acide de Lewis) modéré, et les solutions de chlorure de zinc ont un pH voisin de 4. Lorsqu'il est chauffé sous une forme hydratée, il s'hydrolyse pour former de l'oxychlorure de zinc.
En solution aqueuse, le chlorure de zinc est une source d'ions Zn2+ utile pour la préparation d'autres sels de zinc comme par exemple le carbonate de zinc :
ZnCl2(aq) + Na2CO3(aq) → ZnCO3(s) + 2 NaCl(aq)
Applications
Le chlorure de zinc est notamment utilisé pour le soudage, du fait de sa capacité de dissoudre les oxydes métalliques lors qu'il est à l'état fondu. Cette propriété permet également de l'utiliser dans les ciments à base d'oxyde de magnésium pour les prothèses dentaires. ZnCl2 est utilisé également comme agent d'ignifugation et comme réactif d'attaque de métaux.
Le chlorure de zinc est également utilisé dans la galvanisation, ainsi que dans le production de batteries.
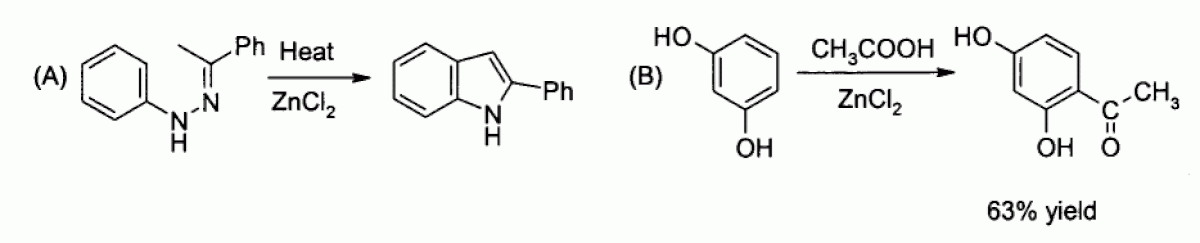
En laboratoire, le chlorure de zinc est utilisé en tant qu'acide de Lewis modéré. Il peut jouer le rôle de catalyseur pour la synthèse de Fisher de l'indole (A) ou pour l'acylation de Friedel-Crafts mettant en jeu un composé aromatique (B) :
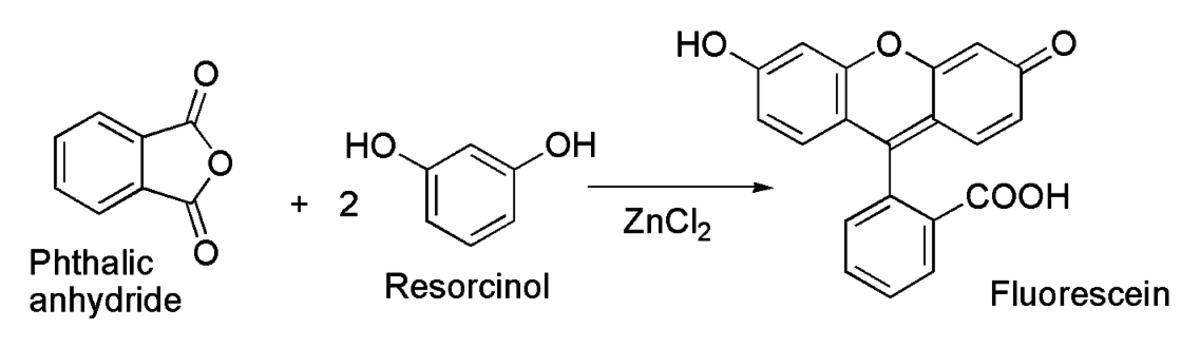
Il est notamment utilisé pour la préparation de fluorescéine par acylation de Friedel-Crafts à partir d'anhydride phtalique et de résorcinol :
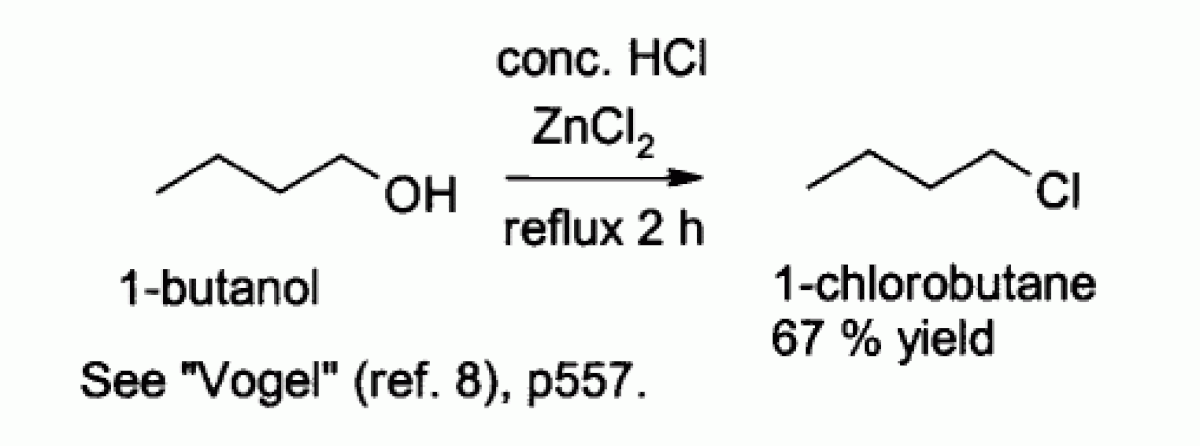
L'acide chlorhydrique seul réagit mal avec les alcools primaires et les alcools secondaires, mais un mélange d'acide chlorhydrique et de chlorure de zinc (mélange connu sous le nom de "réactif de Lucas"), permet la préparation de chlorures d'alkyles. Le mécanisme de cette réaction est probablement de type SN2 avec les alcools primaires et de type SN1 avec les alcools secondaires.
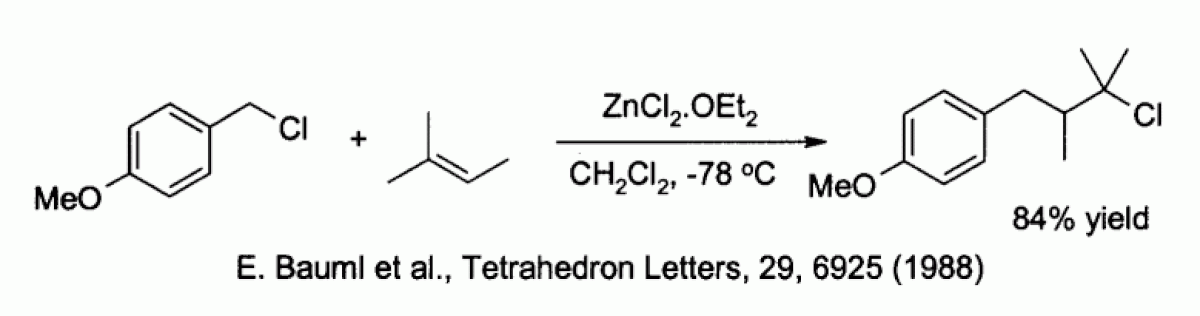
Le chlorure de zinc est capable d'activer des halogénures de benzyle ou d'allyle ce qui permet des réactions de substitution par des nucléophiles faibles comme les alcènes :
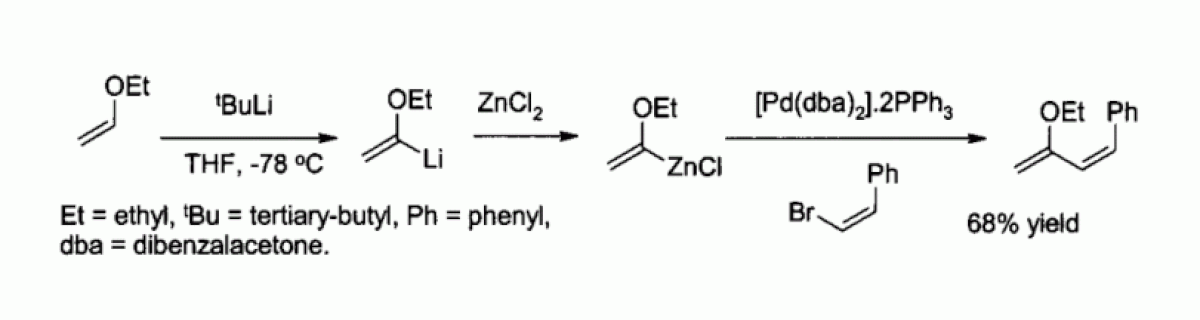
Le chlorure de zinc est également un réactif utilisé pour la synthèse de nombreux réactifs de type organozincites, comme par exemple ceux utilisés pour le couplage de Negishi avec des halogénures d'aryle ou de vinyle. L'organozincite est alors généralement préparé par échange métallique avec un organolithié ou un réactif de Grignard, comme par exemple dans :
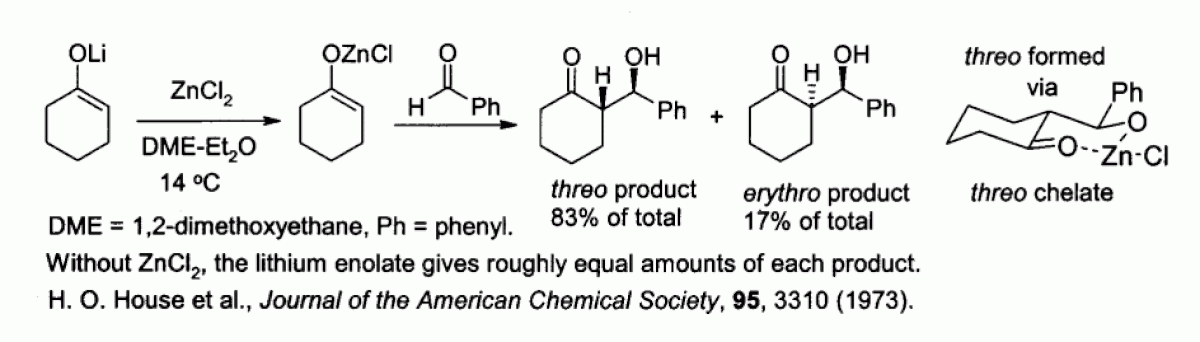
Les énolates de zinc, préparés à partir d'énolates de métaux alcalins et de chlorure de zinc, permettent de contrôler la stéréochimie lors de réactions de condensation d'aldols, du fait de la chélation du zinc. Dans l'exemple ci-dessous, le produit thréo est favorisé par rapport au produit érythro (facteur 5/1) lorsque est utilisé du chlorure de zinc :