Cryolithe - Définition
La liste des auteurs de cet article est disponible ici.
Cryolithe artificielle
L'unique gisement de cryolithe ne peut fournir les besoins industriels.
Elle est fabriquée par diverses techniques reposant sur le mélange de : acide fluorhydrique (HF), fluorure de sodium (NaF), fluorure d'ammonium, acide fluosilicique, acide fluoborique, hydroxyde d'aluminium, sulfate d'aluminium, aluminate de sodium, soude (NaOH), carbonate de sodium, chlorure de sodium (NaCl), sulfate de sodium.
Dans les applications industrielles, elle se présente le plus souvent sous forme de poudre blanche.
La production mondiale (avec le fluorure d'aluminium AlF) est de plus de 400 000 tonnes par an.
Utilisation
L'aluminium
La cryolithe est principalement utilisée comme fondant dans la production d'aluminium. Elle est mélangée à l'alumine extraite de la bauxite. Le mélange est fondu aux environs de 950 °C et ensuite électrolysé.
Elle a été choisie parce qu'elle dissout les fluorures et les oxydes (dont l'alumine) mais pas l'aluminium, elle conduit le courant électrique et elle fond à 1 000 °C.
Le verre et la céramique
Pour la fabrication des verres, la cryolithe est utilisée comme fondant et opacifiant. De même, elle abaisse la viscosité du verre en fusion, facilitant ainsi la suppression des bulles.
Comme dans le cas de l'alumine, c'est grâce à son pouvoir de dissolution des oxydes (SiO, CaO par exemple) qu'elle abaisse la température de fusion de ces oxydes en formant des eutectiques. Son pouvoir opacifiant est utilisé pour augmenter l'opalescence (couleur de l'opale, pierre semi-précieuse de couleur blanche nacrée à reflet de nacre) de certains verres.
Elle entre dans la composition de certains émaux blancs dans des proportions allant de 5 à 15 % en masse. Elle aide à donner un aspect glacé par l'apport de fluorure.
Bibliographie
Pour la partie historique :
- Helge Kragh (Institut des sciences exactes, Université Aarhus) in From curiosity to industry, the early history of cryolite soda manufacture, Cahier d'histoire de l'aluminium, n°18 , été 1996.
Cristallographie
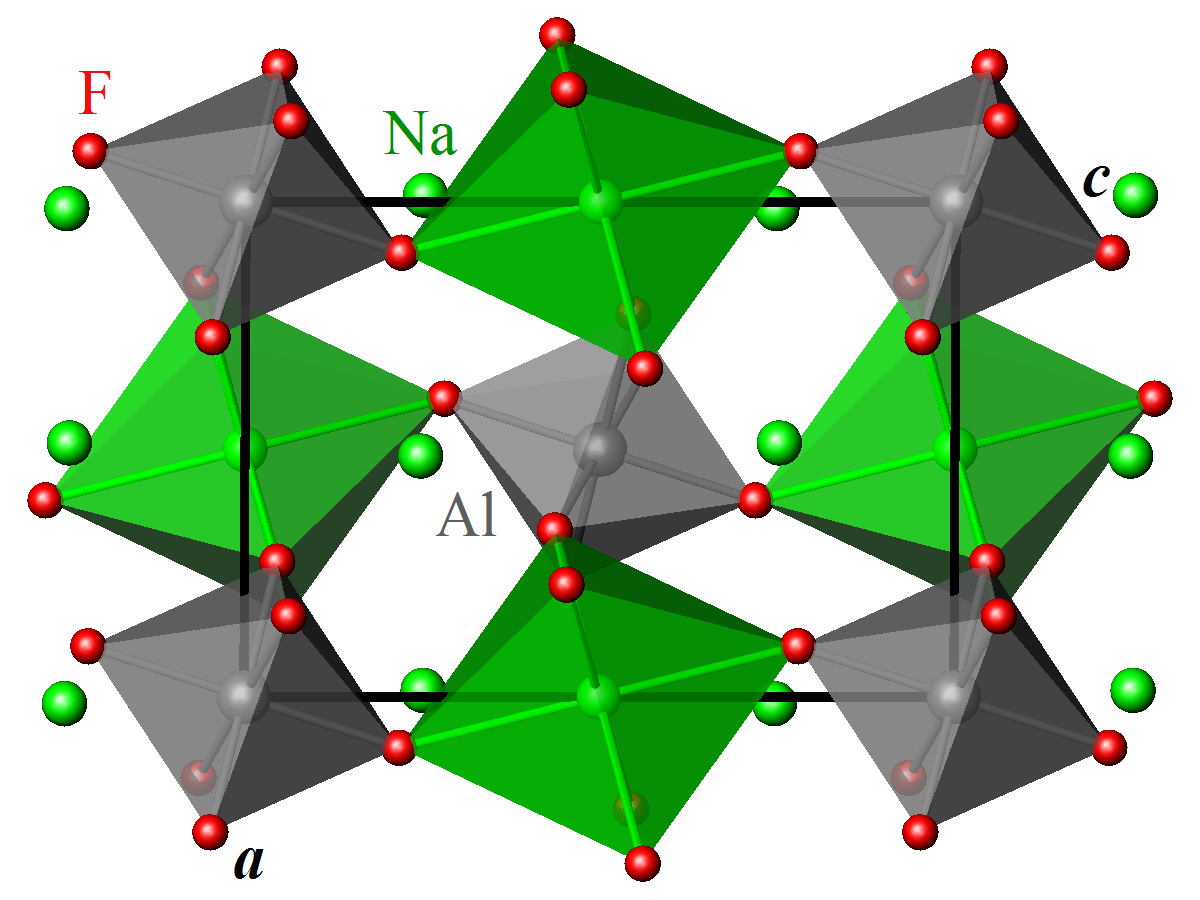
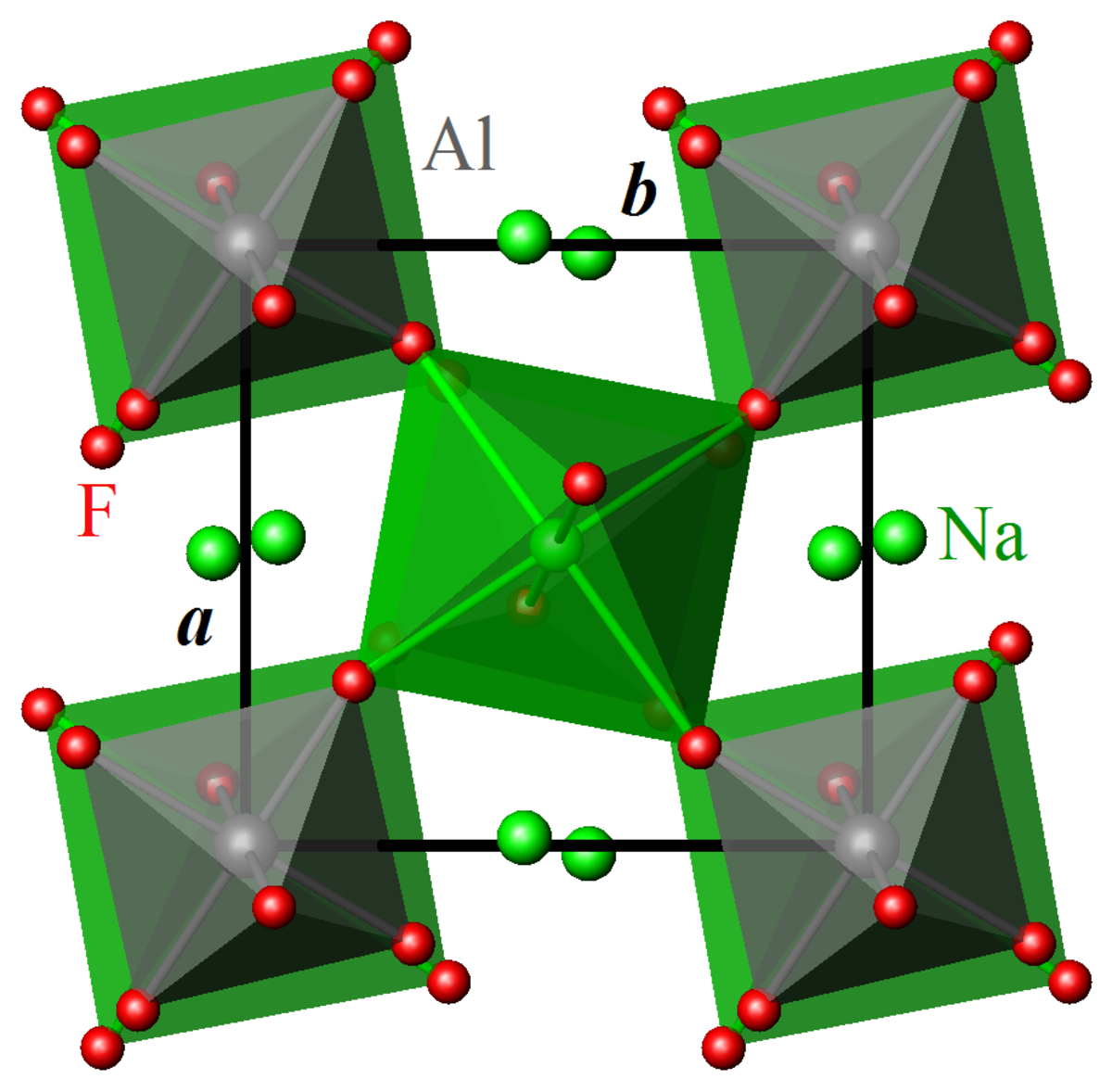
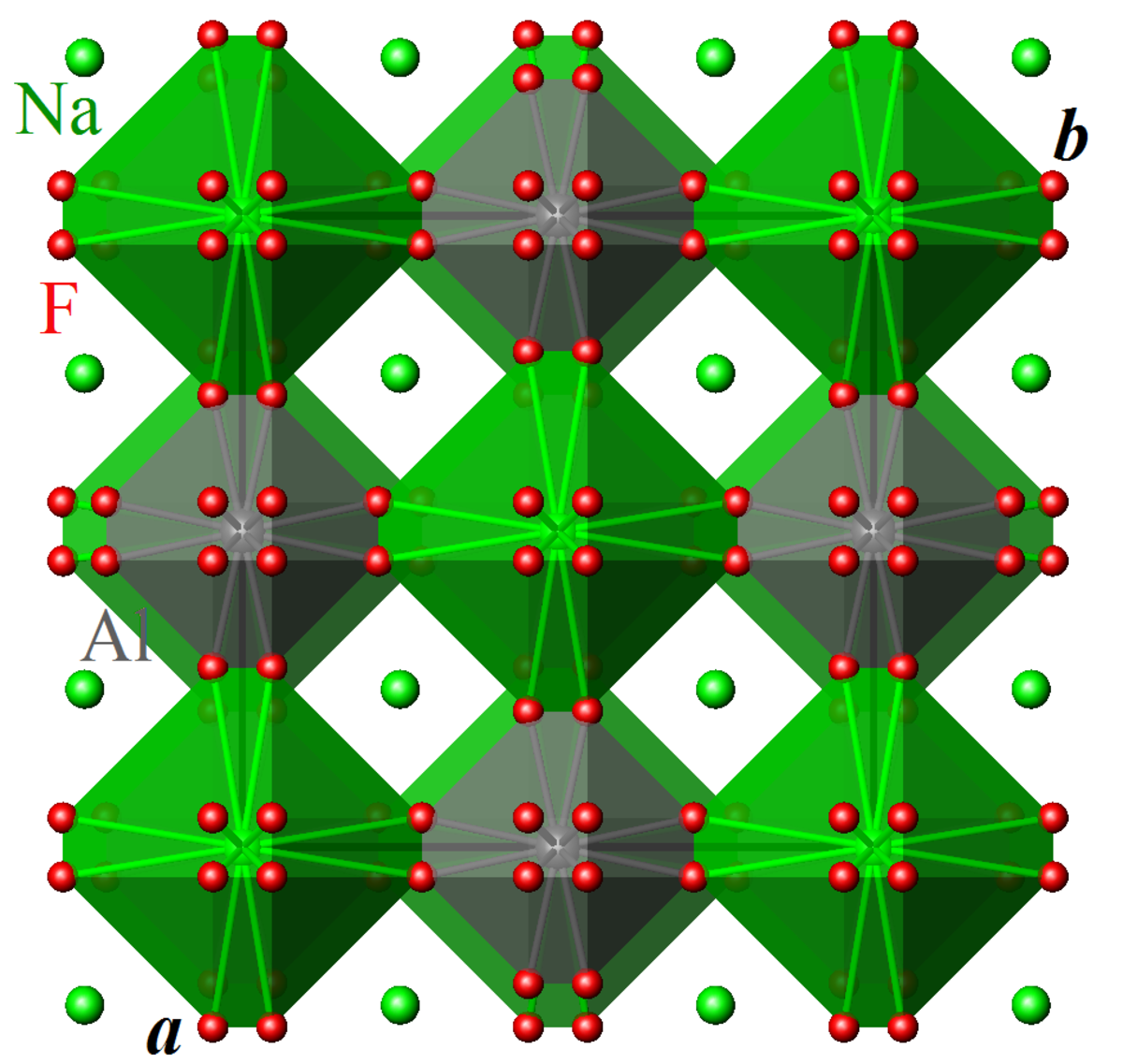
À température ambiante, la cryolithe cristallise dans le groupe d'espace monoclinique P2/n (Z = 2).
- Paramètres de la maille conventionnelle : a = 5,402 Å, b = 5,596 Å, c = 7,756 Å, β = 90,28° ; V = 234,5 Å3
- Densité calculée = 2,97 g/cm3
Les cations Al3+ sont en coordination octaédrique légèrement déformée d'anions F–.
Les cations Na+ occupent deux sites non-équivalents, Na1 et Na2 :
- Na1 est en coordination octaédrique légèrement déformée de F– ;
- Na2 a pour voisins 8 anions F–.
Les octaèdres AlF6 et Na1F6 sont reliés dans les trois directions de l'espace par leurs sommets. La structure de la cryolithe est dérivée de la structure pérovskite ABX3, avec un site A occupé par Na2 et un site B partagé de façon alternée entre Na1 et Al. La différence de taille entre les octaèdres AlF6 et Na1F6 (longueurs de liaison moyennes
À 565 °C, la cryolite subit une transition de phase structurelle et devient cubique, de groupe d'espace Fm3m (Z = 4) avec a = 8,023 Å, V = 516,5 Å3 et de densité calculée 2,7 g/cm3 à 800 °C. Les sites de fluor deviennent désordonnés et sont occupés à 25 % autour des axes quaternaires de rotation, indiquant des fluctuations spatiales et temporelles des atomes. Ces fluctuations d'origine thermique permettent de compenser localement les problèmes créés par la différence de taille entre les octaèdres AlF6 et Na1F6.