Électronégativité - Définition
La liste des auteurs de cet article est disponible ici.
Tableau (échelle de Pauling)
L'électronégativité des éléments chimiques d'un même groupe du tableau périodique (c'est-à-dire d'une même colonne du tableau périodique) a tendance à décroître lorsque le numéro atomique croît, car le noyau atomique tend alors à « s'éloigner » des électrons de valence, qui sont davantage écrantés par les électrons de cœur. En revanche, l'électronégativité des éléments d'une même période du tableau périodique a tendance à croître avec le numéro atomique, car la charge électrique du noyau atomique (nombre de protons) augmente et interagit davantage avec les électrons de valence. Le minimum est donc à rechercher en bas à gauche du tableau (au niveau du francium) tandis que le maximum se trouve en haut à droite (au niveau du fluor).
| H 2,2 | He | ||||||||||||||||
| Li 0,98 | Be 1,57 | B 2,04 | C 2,55 | N 3,04 | O 3,44 | F 3,98 | Ne | ||||||||||
| Na 0,93 | Mg 1,31 | Al 1,61 | Si 1,9 | P 2,19 | S 2,58 | Cl 3,16 | Ar | ||||||||||
| K 0,82 | Ca 1 | Sc 1,36 | Ti 1,54 | V 1,63 | Cr 1,66 | Mn 1,55 | Fe 1,83 | Co 1,88 | Ni 1,91 | Cu 1,9 | Zn 1,65 | Ga 1,81 | Ge 2,01 | As 2,18 | Se 2,55 | Br 2,96 | Kr |
| Rb 0,82 | Sr 0,95 | Y 1,22 | Zr 1,33 | Nb 1,6 | Mo 2,16 | Tc 2,1 | Ru 2,2 | Rh 2,28 | Pd 2,2 | Ag 1,93 | Cd 1,69 | In 1,78 | Sn 1,96 | Sb 2,05 | Te 2,1 | I 2,66 | Xe 2,6 |
| Cs 0,79 | Ba 0,89 | * | Hf 1,3 | Ta 1,5 | W 1,7 | Re 1,9 | Os 2,2 | Ir 2,2 | Pt 2,2 | Au 2,4 | Hg 1,9 | Tl 1,8 | Pb 1,8 | Bi 1,9 | Po 2 | At 2,2 | Rn |
| Fr 0,7 | Ra 0,9 | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| * | La 1,1 | Ce 1,12 | Pr 1,13 | Nd 1,14 | Pm | Sm 1,17 | Eu | Gd 1,2 | Tb | Dy 1,22 | Ho 1,23 | Er 1,24 | Tm 1,25 | Yb | Lu 1 | ||
| ** | Ac 1,1 | Th 1,3 | Pa 1,5 | U 1,7 | Np 1,3 | Pu 1,3 | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||
Échelles d'électronégativité
Il existe plusieurs définitions de l'électronégativité (Pauling, Mulliken, Parr, Allred et Rochow) ce qui a conduit à construire plusieurs échelles.
- Définition de Pauling : la différence d'électronégativité entre les éléments A et B a pour expression
où EAB,EAA et EBB sont les énergies de liaison des molécules diatomiques A-B, A-A et B-B.
Cette définition ne donne que la différence entre deux électronégativités. On a donc besoin d'une origine qui a été fixée arbitrairement en donnant la valeur de 4 à l'électronégativité du fluor (élément le plus électronégatif de la classification).
- Définition de Mulliken : l'électronégativité d'un élément est le produit de la moyenne de son affinité électronique Ae et de son énergie d'ionisation EI avec un coefficient alpha=0.317 :
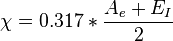
- Définition d'Allred et Rochow : l'électronégativité d'un élément a pour expression
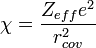
où Zeff est la charge effective du noyau,e la charge élémentaire et rcov le rayon covalent de l'élément
- Définition de Parr: l'électronégativité est l'opposée de la dérivée de l'énergie de l'atome par rapport au nombre d'électrons
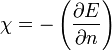
Les échelles d'électronégativité les plus utilisées sont l'échelle de Mulliken, l'échelle d'Allred-Rochow et l'échelle de Pauling.
Les électronégativités des atomes impliqués dans une liaison tendent à être égales (principe d'égalisation des électronégativités de Sanderson, 1951). L'égalisation des électronégativités est réalisée par le transfert de densité électronique vers l'atome le plus électronégatif.
L'électronégativité permet d'estimer le caractère ionique d'une liaison à l'aide de la relation de Pauling
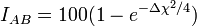
ou de celle de Haney et Smith
L'électronégativité est également la notion à l'origine de la polarité de certaines molécules. En effet, dans une molécule, lorsque les atomes de part et d'autre de la liaison covalente ont des électronégativités différentes, l'atome le plus électronégatif attire davantage les électrons. Le barycentre des charges positives n'est donc pas confondu avec le barycentre des charges négatives. La molécule reste globalement neutre mais un champ électrique apparaît au sein de celle-ci, on dit que la liaison est polarisée ou que la molécule est polaire.
Les éléments dont l'électronégativité est faible sont fréquemment dits électropositifs.

















































