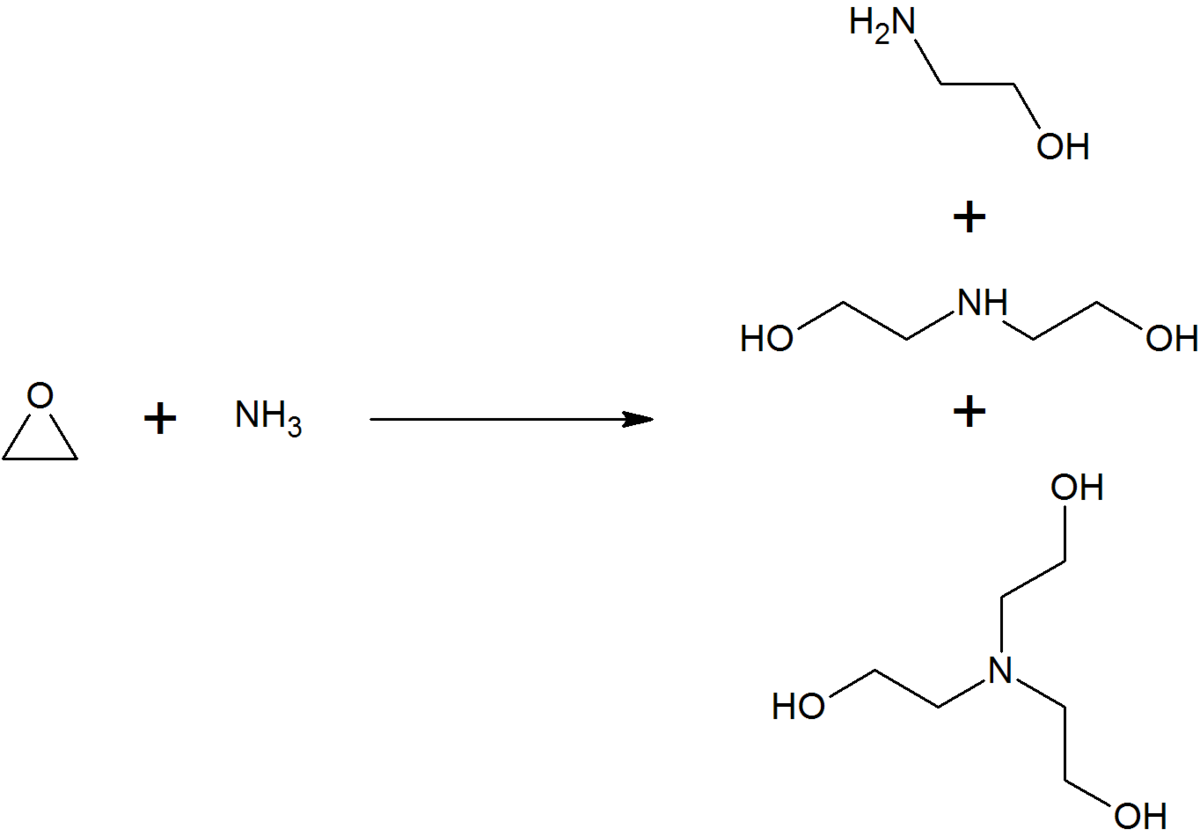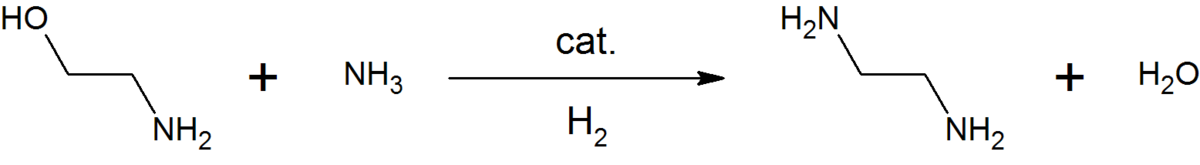Éthanolamine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Éthanolamine | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | 2-amino-l-éthanol, éthanolamine, monoéthanolamine, β-aminoéthanol, β-hydroxyéthylamine, alcool β-aminoéthyliquel, glycinol, olamine, MEA | |
| No CAS | ||
| No EINECS | ||
| No RTECS | ||
| PubChem | ||
| ChEBI | ||
| SMILES | ||
| InChI | ||
| Apparence | liquide visqueux incolore avec une odeur d'ammoniac | |
| Propriétés chimiques | ||
| Formule brute | C2H7NO | |
| Masse molaire | 61,0831 ± 0,0026 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 10,3 °C | |
| T° ébullition | 170 °C | |
| Masse volumique | 1,012 g·cm-3 | |
| T° d’auto-inflammation | 410 °C | |
| Point d’éclair | 85 °C | |
| Limites d’explosivité dans l’air | 5,5 - 17% | |
| Pression de vapeur saturante | 25 Pa à 20 °C | |
| Thermochimie | ||
| Cp | ||
| Propriétés optiques | ||
| Indice de réfraction |
| |
| Précautions | ||
| | ||
| ||
| Phrases R : 20, 34, 36/37/38, | ||
| Phrases S : 26, 27, 36/37, 39, 45, | ||
| | ||
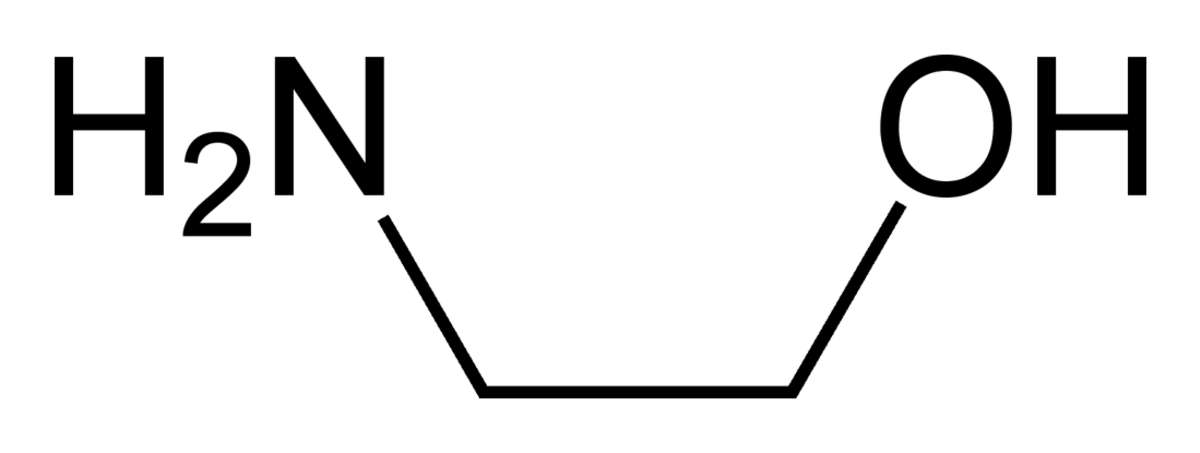
L'éthanolamine, également appelée 2-aminoéthanol ou monoéthanolamine, est un composé chimique organique qui est à la fois une amine primaire (par son groupe amine) et un alcool primaire (par son groupe hydroxyle). À l'instar des autres amines, la monoéthanolamine se comporte en base faible. L'éthanolamine est un liquide toxique, inflammable, corrosif, incolore et visqueux ; son odeur est similaire à celle de l'ammoniac.
L'éthanolamine est communément appelée monoéthanolamine afin de la distinguer de la diéthanolamine et de la triéthanolamine. Le groupe éthanolamine est le deuxième plus fréquent groupe de tête des phospholipides, des substances que l'on retrouve dans les membranes biologiques.
Production
On produit la monoéthanolamine en faisant réagir l'oxyde d'éthylène avec l'ammoniaque aqueux ; cette réaction produit également de la diéthanolamine et de la triéthanolamine. Il est possible d'exercer un contrôle sur les proportions de ces produits en changeant la stœchiométrie des réactifs.
Applications
La monoéthanolamine est utilisée en solution aqueuse pour neutraliser certains gaz. Elle sert d'ingrédient de base dans la production de détergents, émulsifiants,, produits pharmaceutiques, inhibiteurs de corrosion, etc. Par exemple, la réaction entre l'éthanolamine et l'ammoniac donne de l'éthylènediamine, un agent chélateur courant :