Expérience de Franck et Hertz - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
L'expérience de Franck et Hertz est une expérience établie pour la première fois en 1914 par James Franck et Gustav Hertz. Elle a pour objet de prouver la quantification des niveaux d'énergie des électrons dans les atomes, ce qui en fait l'une des expériences fondamentales de la physique quantique. Elle a ainsi permis de confirmer les hypothèses du modèle de l'atome de Bohr.
En 1925, Franck et Hertz reçurent le prix Nobel de physique pour cette expérience.
Historique
En 1913, Niels Bohr proposa le modèle de l'atome de Bohr, basé sur le modèle de l'atome de Rutherford, mais y apporta deux postulats, dont celui de la quantification des orbites électroniques. Ainsi, les premières expériences consistant à mettre en évidence cette quantification utilisaient de la lumière qui, comme il était déjà connu à l'époque, était formée de « quanta d'énergie ». La première objection émise contre l'interprétation de ces expériences par la théorie de Bohr fut donc de prétendre que la quantification des orbites n'était due qu'à la seule quantification des photons.
En 1914, Franck et Hertz, qui travaillaient sur les énergies d'ionisation des atomes, mirent au point une expérience faisant intervenir les niveaux d'énergie de l'atome de mercure. Leur expérience n'utilisant que des électrons et du mercure sans lumière, Bohr y trouva la preuve irréfutable de son modèle de l'atome.
Expérience
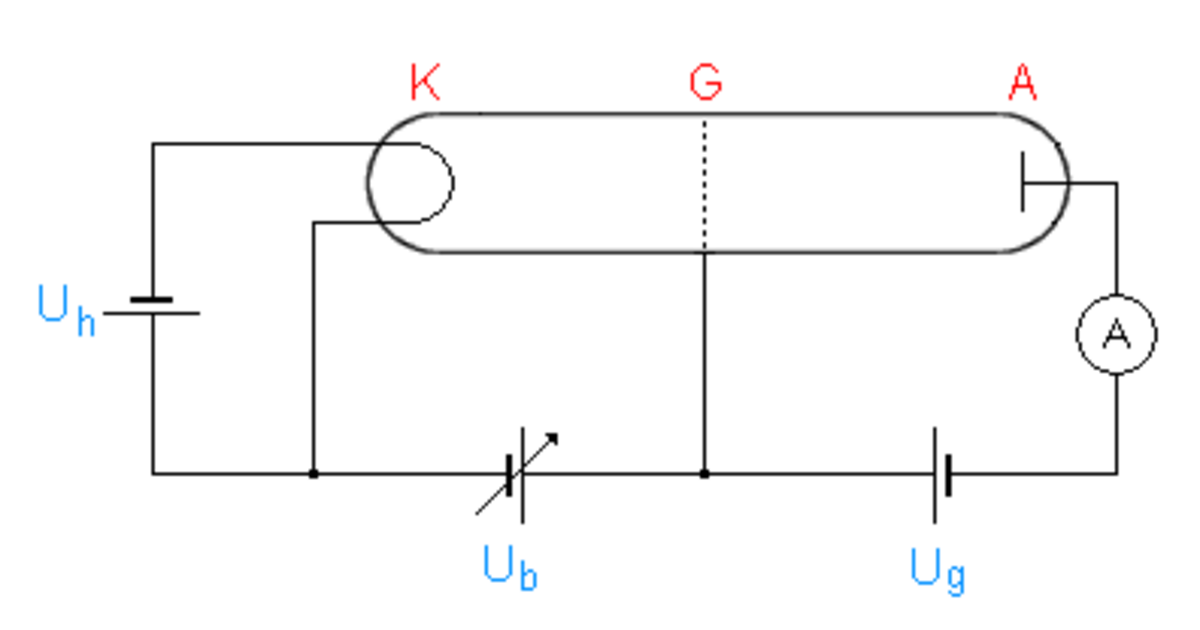
Dans l'expérience, Franck et Hertz ont fait circuler un faisceau d'électrons dans un tube à vide contenant du mercure gazeux. Pour y arriver, ils ont utilisé une triode, c'est-à-dire un dispositif composée d'une cathode, d'une grille polarisée et d'une anode.
Les électrons, émis de la cathode, peuvent alors entrer en collision avec des atomes de mercure durant leur course entre la cathode et l'anode. Il y a deux types de chocs :
- des chocs élastiques où il n'y a pas de transfert d'énergie des électrons du faisceau avec les atomes de mercure percutés, et les électrons gardent donc leur énergie,
- des chocs inélastiques, et dans ce cas, les électrons émis par la cathode vont percuter les électrons de plus basse énergie des atomes de mercure, et ceux-ci vont passer sur une orbite d'énergie supérieure, suivant l'interprétation de Bohr.
La variation de courant reçu par l'anode est mesurée en fonction de l'énergie cinétique des électrons, et il est ainsi possible d'en déduire les pertes d'énergie des électrons lors des collisions.
Détails de l'expérience
L'ensemble de la triode est contenu à l'intérieur d'une capsule en verre qui contient le mercure. L'expérience peut être réalisée pour différentes températures, mais le mercure doit être sous forme gazeuse afin de permettre la circulation des électrons. Le mercure devient gazeux à partir de 630 K sous pression atmosphérique, mais il est possible d'éviter d'avoir à obtenir une telle température, en travaillant à pression réduite et en chauffant entre 100 °C et 200 °C.
Pour que les électrons soient arrachés et qu'ils aient une vitesse suffisamment importante, une tension d'accélération est établie entre la cathode et la grille.
Résultats
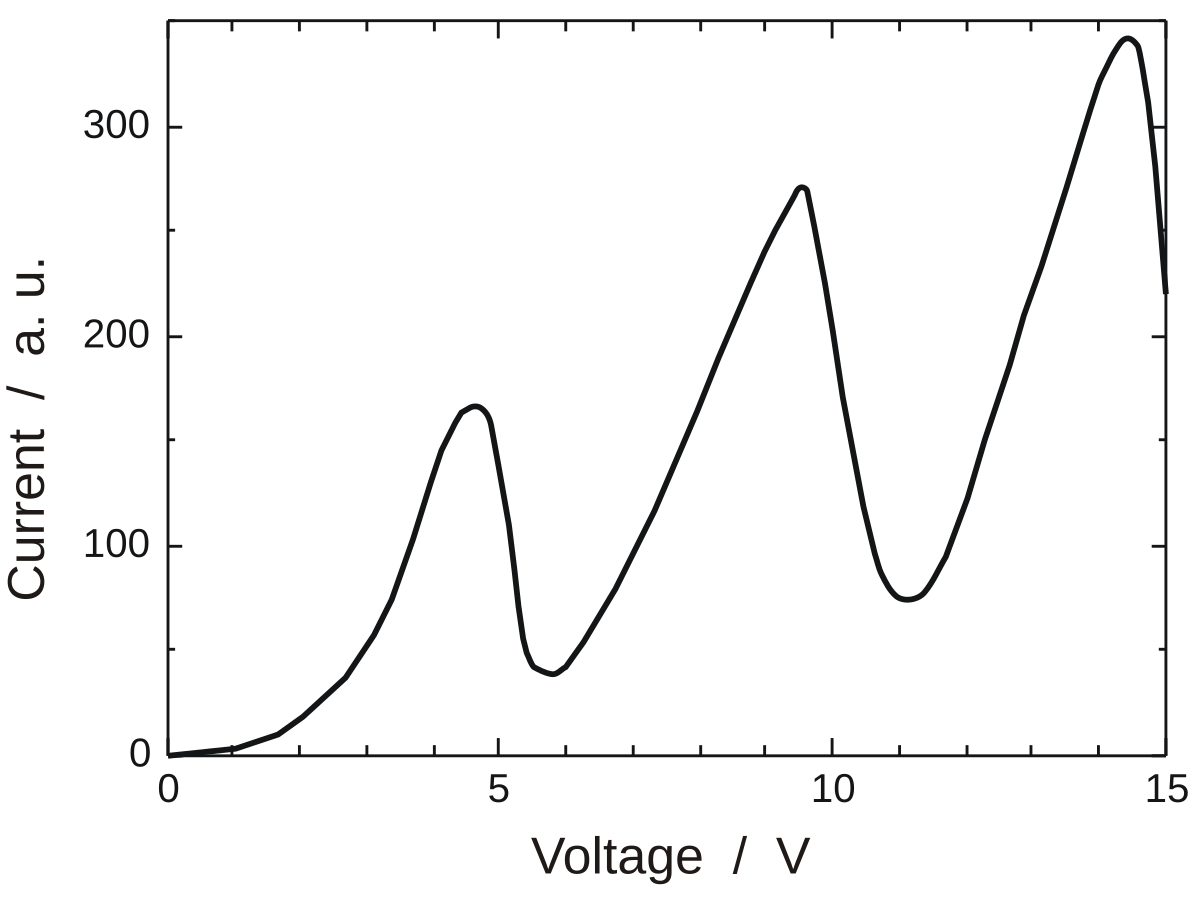
La courbe représentant le courant de l'anode en fonction de la tension aux bornes de la cathode, montre qu'il y a bien des pics d'absorption. L'énergie (et alors la vitesse) des électrons est représentée par le potentiel électrique que subissent les électrons. Cette courbe est de type pseudo-périodique de période 4,9 V et dont l'amplitude augmente en fonction de la tension d'extraction.
La température des atomes de mercure est directement reliée à l'agitation des atomes et donc à la probabilité de chocs entre les atome de mercure et les électrons extraits de la cathode. Plus la température sera élevée, plus les atomes de mercure seront mobiles, et plus ils rencontreront un grand nombre d'électrons. En augmentant la température du mercure, la hauteur des creux diminuent, ils se rapprochent alors de l'axe des abscisses.