Hexafluorure d'uranium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Hexafluorure d'uranium | |||
|---|---|---|---|
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | cristaux incolores a blancs, deliquescents. | ||
| Propriétés chimiques | |||
| Formule brute | UF6 | ||
| Masse molaire | 352,01933 ± 3,0E-5 g·mol-1 | ||
| Moment dipolaire | nul | ||
| Propriétés physiques | |||
| T° fusion | 64,8 °C | ||
| T° ébullition | 56,5 °C (sublimation) | ||
| Solubilité | dans l'eau à 20 °C : réaction | ||
| Masse volumique | 5,09 g·cm-3solide | ||
| Pression de vapeur saturante | à 20 °C : 14,2 kPa | ||
| Point critique | 46,6 bar, 232,65 °C | ||
| Point triple | 64 °C, 150 kPa | ||
| Thermochimie | |||
| S0 | 228 J.K−1.mol−1 | ||
| ΔH0 | -2317 kJ/mol | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 14,00 ± 0,10 eV (gaz) | ||
| Cristallographie | |||
| Structure type | Hexagonal compact (HC) | ||
| Forme de la molécule | Octaèdre | ||
| Coordinence | Pseudo-octaédrale | ||
| Précautions | |||
| | |||
| |||
| | |||
|
0 0 0 ☢ | |||
| Composés apparentés | |||
| Cations apparentés | Fluorure de thorium (IV) Fluorure de protactinium (V) | ||
| Anions apparentés | Chlorure d'uranium (VI) | ||
| Autres composés | Trifluorure d'uranium Tétrafluorure d'uranium | ||
| | |||
L'hexafluorure d'uranium (UF6) est un composé de l'uranium. Son utilisation industrielle est liée au cycle du combustible nucléaire (procédé qui produit du combustible pour les réacteurs nucléaires et les armes nucléaires). Sa synthèse chimique, qui intervient après l'extraction de l'uranium, fournit ensuite l'entrée au procédé d'enrichissement.
Propriétés
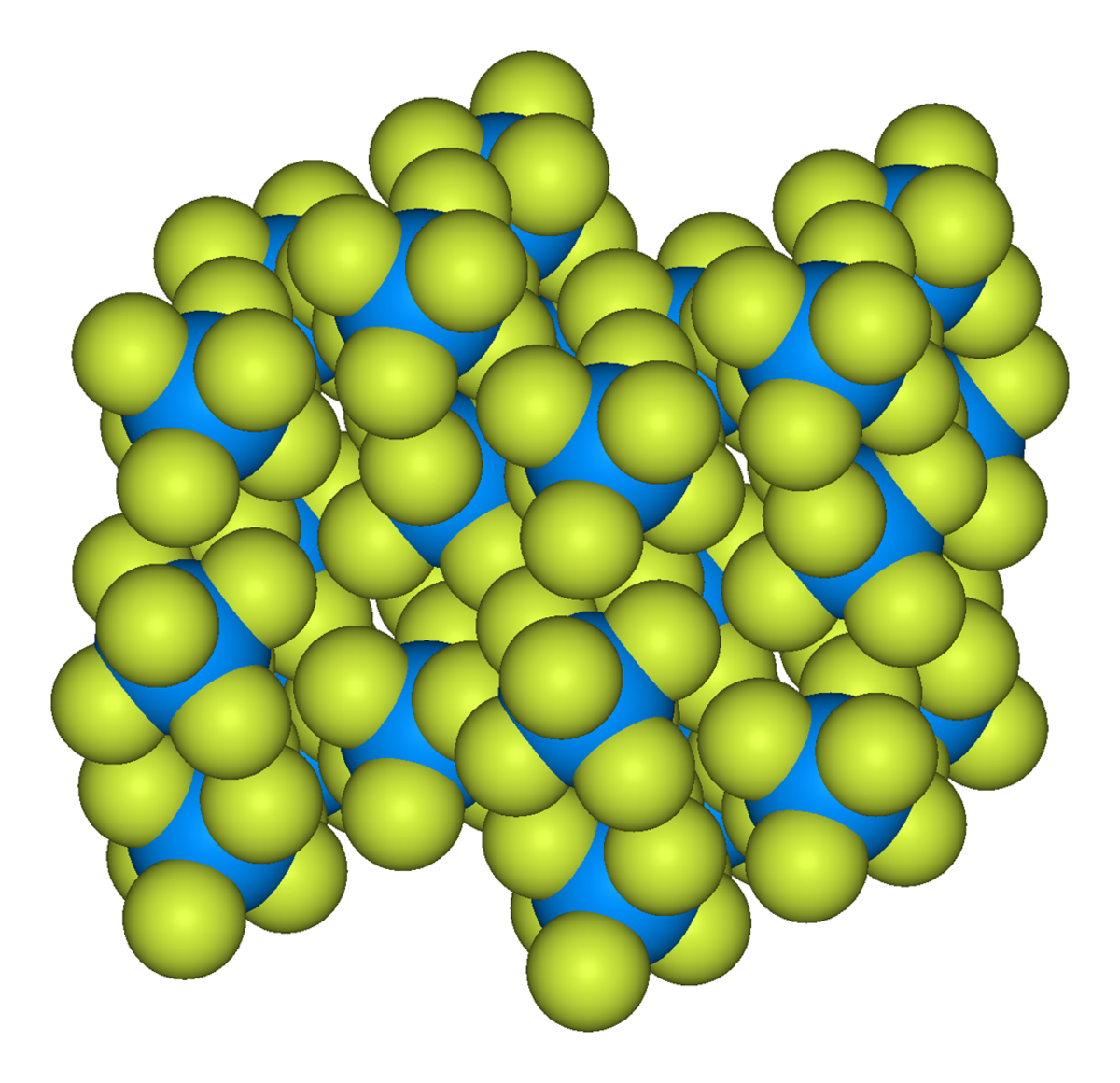
Propriétés physiques
L'hexafluorure d'uranium est solide à température ambiante (~20 °C), il se présente sous la forme de cristaux gris dans les conditions normales de température et de pression (CNTP). Sa pression de vapeur arrive à 1 atmosphère à 56,4 °C. Dans un milieu ouvert à l'air, il se sublime de façon irréversible.
Sa phase liquide apparait à partir de son point triple, à 1,5 atm et à 64 °C (147 °F, 337 K).
La structure du solide a été décrite par J.H. Levy, J.C Taylor et A.B Waugh. Dans cet article, la diffraction neutronique a été utilisée pour déterminer la structure de UF6, MoF6 et WF6 à 77 K.
Propriétés chimiques
Outre sa radioactivité due à l'uranium, c'est un produit hautement toxique, qui réagit violemment avec l'eau. En atmosphère humide ou en présence d'eau, il se transforme en fluorure d'uranyle (UO2F2) et acide fluorhydrique (HF). La transformation est immédiate et violente et s'accompagne d'émission d'abondantes fumées opaques, irritantes et suffocantes de HF.
Le produit est corrosif pour la plupart des métaux. Il réagit faiblement avec l'aluminium, formant une fine couche de AlF3 qui résiste ensuite à la corrosion (passivation).
Il a été montré que l'hexafluorure d'uranium est un oxydant et un acide de Lewis qui peut se lier à un fluorure, par exemple la réaction du fluorure de cuivre avec l'hexafluorure d'uranium dans l'acétonitrile est réputée former Cu[UF7]2·5 MeCN.
Les fluorures d'uranium(VI) polymères contenant des cations organiques ont été isolés et caractérisés par diffraction de rayons X.
Autres fluorures d'uranium
Le pentafluorure d'uranium (UF5) et le nonafluorure de diuranium (U2F9) ont été caractérisés par C.J. Howard, J.C Taylor et A.B. Waugh.
Le trifluorure d'uranium a été caractérisé par J. Laveissiere.
La structure de UOF4 a été décrite par J.H. Levy, J.C. Taylor et P.W. Wilson.
Tous les autres fluorures d'uranium sont des solides non volatils qui sont des polymères de coordination.


















































