Maladie de Chagas - Définition
La liste des auteurs de cet article est disponible ici.
Diagnostic de laboratoire
La mise en évidence de l'agent causal est la procédure de diagnostic utilisée dans la phase aiguë de la maladie de Chagas. Elle donne presque toujours des résultats positifs, et peut être réalisée par :
- Examen au microscope :
a) De sang frais prélevé sur anticoagulant ou culot globulaire, pour les parasites mobiles ;
b) Un étalement de sang contaminé sur lame fixé au colorant de Giemsa, pour la visualisation du parasite ; il peut être confondu avec Trypanosoma rangeli , 50% plus long qui n'est pas considéré comme pathogène pour l'homme.
- Isolement de l'agent par :
a) Inoculation à la souris;
b) Culture sur milieu spécial (par exemple, NNN, LIT), etc.)
c) Xénodiagnostic, un test au cours duquel les Réduves, des insectes non infectés sont nourries par le sang du patient, et le contenu de leur intestin est testé pour une recherche de parasites pendant les 4 semaines qui suivent.
- Tests variés de diagnostic immunologique; (en essayant également de distinguer les souches de (zymodemes) des T.cruzi qui ont une pathogénicité différente).
- Fixation du complément.
- Hémagglutination indirecte.
- Analyse en immunofluorescence indirecte.
- Analyse en radioimmunologie.
- Analyse ELISA (titrage immunoenzymatique utilisant un antigène absorbé).
- Diagnostic par des techniques de biologie moléculaire.
- PCR, réaction en chaîne de polymérase, la technique la plus prometteuse
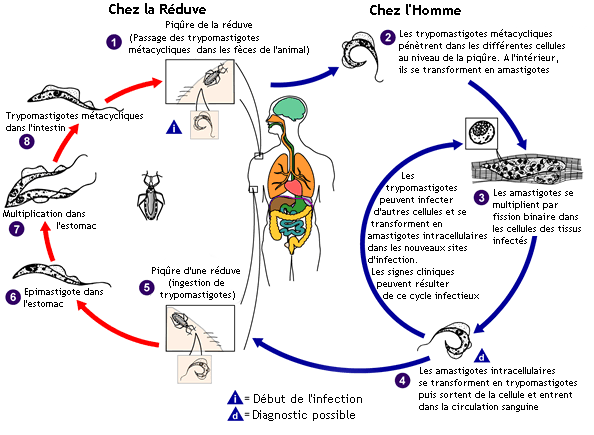
Cycle parasitaire
Trypanosoma cruzi fait partie du même genre que l'agent infectieux responsable de la maladie du sommeil africaine, mais ses manifestations cliniques, sa répartition géographique, son cycle de vie et son insecte vecteur sont tout à fait différents. Un insecte vecteur infecté du genre triatomine se nourrit du sang d’un mammifère et libère des trypomastigotes dans ses déjections près du point de piqûre. La victime, en grattant l'emplacement de la plaie, fait pénétrer des trypomastigotes dans l’hôte par la blessure, ou par des muqueuses saines, telles que la conjonctive. Puis, à l’intérieur de l’hôte, les trypomastigotes envahissent les cellules, où ils se transforment en amastigotes intracellulaires. Les amastigotes se divisent par scissiparité et se métamorphosent en trypomastigotes, puis sont libérés dans la circulation comme trypomastigotes circulants. Ces trypomastigotes infectent des cellules d'un type particulier et se transforment en amastigotes intracellulaires dans de nouveaux sites d'infection. Des manifestations cliniques et la mort des cellules des tissus cible peuvent se produire en raison de ce cycle infectieux. Par exemple, il a été montré par l’anatomopathologiste autrichien et brésilien, le Dr Fritz Köberle dans les années 50 à l’école de Médecine de l'université de São Paulo à Ribeirão Preto, au Brésil, que les amastigotes intracellulaires détruisent les neurones intra-muraux du système nerveux autonome de l'intestin et du cœur, ce qui conduit respectivement au mégacôlon et à l’anévrysme.
Les trypomastigotes circulants ne peuvent pas se diviser (contrairement de ceux du trypanosome africain. La multiplication du parasite reprend seulement quand il envahit une autre cellule ou est ingéré par un autre vecteur. Le kissing bug s’infecte en se nourrissant de sang humain ou animal qui contient des parasites en circulation. D'ailleurs les insectes pourraient répandre l'infection entre eux par leur comportement prédateur et cannibale. Les trypomastigotes ingérés se transforment en épimastigotes dans l’intestin du vecteur. Les parasites se multiplient et se différencient dans l’intestin et deviennent des trypomastigotes métacycliques infectieux dans l’intestin de l’insecte.
Trypanosoma cruzi peut également être transmis à par des transfusions sanguines, des organes transplantés, ou par voie transplacentaire, et le lait maternel, ainsi que dans des accidents de laboratoire. Selon l’Organisation mondiale de la santé, le taux d'infection dans les banques de sang d’Amérique latine varie entre 3% et 53%, soit un niveau plus élevé que pour l'infection à HIV et l’hépatite B et C.
Les enfants peuvent également contracter la maladie de Chagas in utero (pendant la grossesse). La maladie de Chagas explique environ 13% des cas de mortalité périnatale dans certaines régions du Brésil. On recommande femmes enceintes de se faire dépister pour la maladie.
Mécanismes de transmission accessoires
Les chercheurs soupçonnaient depuis 1991 que la transmission du trypanosome était possible par voie orale, en raison d'un certain nombre de micro-épidémies limitées à des périodes et à des endroits particuliers (tels qu'une ferme ou un logement familial), en particulier dans des secteurs non-endémiques tels que l’Amazonie (17 épisodes de ce type ont été enregistrés entre 1968 et 1997). En 1991, des ouvriers agricoles de l'État de Paraíba, au Brésil, ont été apparemment infectés par la consommation de nourriture contaminée par des déjections d’opossum ; et en 1997 à Macapá, dans l'État d’Amapá, 17 membres de deux familles ont été probablement infectés en buvant du jus de fruit de palmier Euterpe oleracea contaminé par des insectes vecteurs écrasés de type triatomine.
Au début de l’année 2005, une nouvelle épidémie avec 27 cas a été signalée dans l’Amapá.
En mars 2005, une nouvelle manifestation spectaculaire a été enregistrée dans l'État de Santa Catarina, au Brésil, qui a semblé confirmer ce mécanisme alternatif de transmission. Plusieurs personnes de Santa Catarina qui avaient ingéré du jus de canne à sucre (garapa, en Portugais) dans un kiosque au bord de la route ont contracté la maladie de Chagas.
En 30 mars 2005, 49 cas avaient été confirmés à Santa Catarina, dont 6 décès.
Le mécanisme présumé, jusqu’à présent, est que des insectes porteurs du trypanosome ont été écrasés dans la matière première. Les services d'hygiène de Santa Catarina ont estimé que 60 000 personnes pouvaient avoir été en contact avec la nourriture contaminée à Santa Catarina et ont invité toutes les personnes concernées à se soumettre à des analyses de sang. Ils ont interdit la vente du jus de sucre de canne dans l'État jusqu'à ce que le risque soit circonscrit.
La gravité inhabituelle de cette épidémie a été attribuée à une hypothétique charge parasitaire particulièrement élevée qui aurait été à l’origine de cette infection transmise par voie orale. Les chercheurs brésiliens de l’Institut Oswaldo Cruz, à Rio de Janeiro, étaient capables d’infecter des souris par voie digestive avec des préparations infectées par le trypanosome.

















































