Pile électrique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction

Une pile électrique (ou plus simplement pile) est un dispositif électrochimique transformant l'énergie d'une réaction chimique en énergie électrique. Dans une pile du commerce, les réactifs sont introduits à la fabrication. Quand ils sont épuisés, la tension s'effondre et on doit remplacer la pile usagée.
À l'origine, le terme désignait un élément unique composé d'un empilement d'une rondelle d'un métal et d'un autre baignant dans un électrolyte. Par extension, le mot « pile » désigne toute batterie monobloc non rechargeable. Cependant, le terme « batterie » désigne un ensemble d'éléments utilisés en série pour obtenir une tension souhaitée, dans un emballage unique. Une batterie peut être rechargeable ou non. Dans le langage courant, c'est généralement une batterie lorsqu'elle est rechargeable, notamment batterie de voiture, au plomb. Mais la locution « pile rechargeable » n'a pas de sens. De même, par abus de langage, le terme « pile » est utilisé pour désigner d'autres générateurs électrochimiques : pile à combustible, accumulateur électrique.
Principe
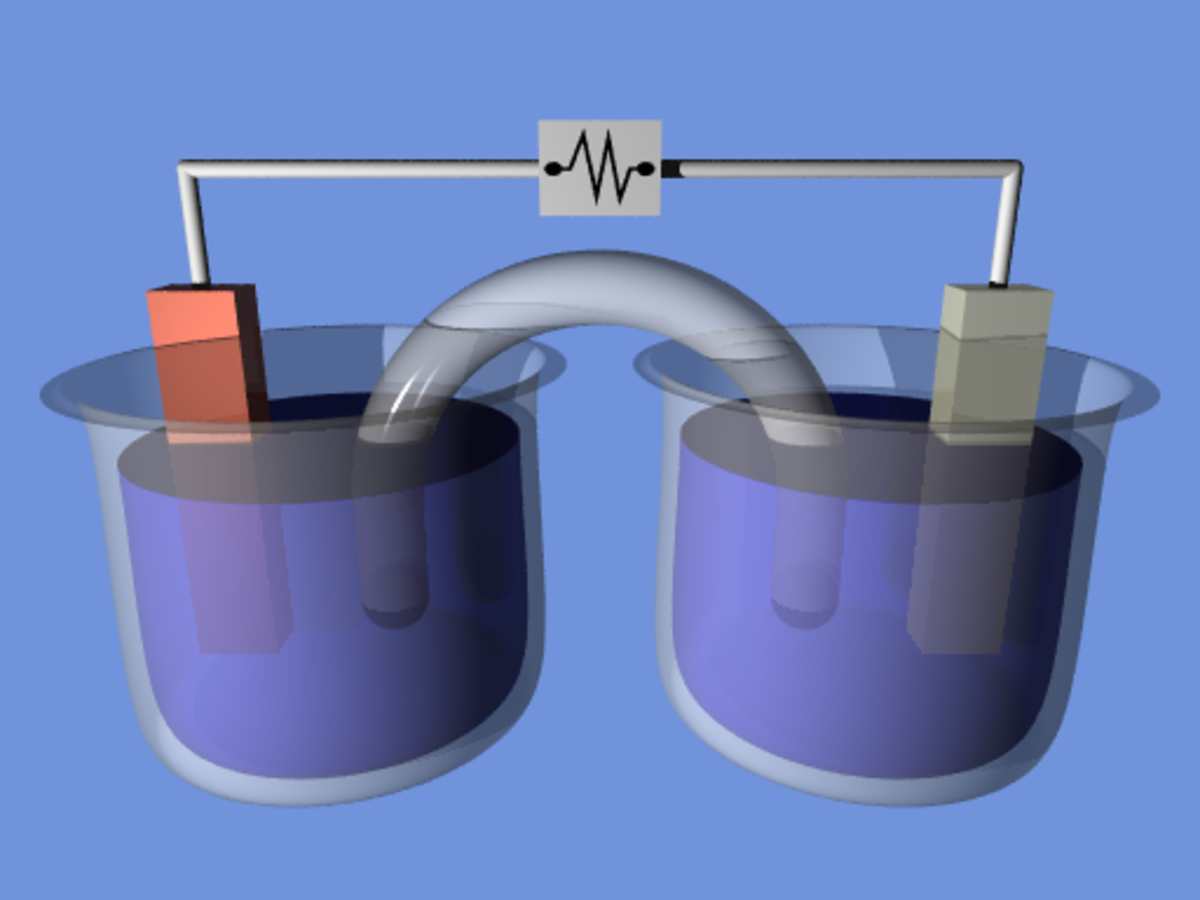
Le boîtier d'une pile abrite une réaction chimique entre deux substances dont l’une peut céder facilement des électrons (matériau réducteur), et l’autre qui les absorbe (matériau oxydant). Chacune de ces réactions chimiques est dite « demi-réaction ». Lorsque proprement combinées, elle forment une réaction d'oxydo-réduction. Chaque demi-réaction survient dans une solution où se produit un échange d'électrons. Ce sont ces électrons qui sont échangés entre les deux substances. Pour assurer l'équilibre des charges électriques, il faut relier les deux solutions à l'aide d'un pont salin, système qui permet le transport de certains ions tout en interdisant la circulation du solvant.
Chaque élément du couple oxydant/réducteur est relié à une électrode. Ces électrodes, lorsqu'elles sont reliées à un consommateur électrique, provoquent la circulation d'un courant électrique ; la réaction chimique provoque une circulation de charges (électrons, ions). Une pile fournit donc du courant continu. La borne (-) d'une pile correspond à l'anode où se produit la réaction d'oxydation qui va fournir les électrons. La borne (+) d'une pile correspond à la cathode où se produit la réaction de réduction qui va consommer les électrons.
Ce système est utilisé pour les piles électriques et les batteries d'accumulateurs, avec divers couples électrochimiques. Une pile électrique peut contenir plusieurs de ces couples montés en série, ce qui permet d'augmenter la tension disponible aux bornes de la pile.
Il est possible de réaliser une pile artisanale, par exemple en piquant dans un citron un trombone déplié (en acier) et un fil électrique dénudé (en cuivre) reliés à une petite lampe ou une diode électroluminescente bien choisie. On trouve dans le commerce des gadgets qui utilisent ce principe : par exemple des petites horloges à quartz qui sont alimentées par une pomme de terre.


















































