Psoralène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Psoralène | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| No CAS | ||
| No EINECS | ||
| SMILES | ||
| InChI | ||
| Apparence | cristaux incolores | |
| Propriétés chimiques | ||
| Formule brute | C11H6O3 | |
| Masse molaire | 186,1635 ± 0,0101 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 163 à 164 °C | |
| Précautions | ||
| | ||
| ||
| Phrases R : 22, 36/37/38, | ||
| Phrases S : 26, | ||
| Écotoxicologie | ||
| LogP | 1,67 | |
| | ||
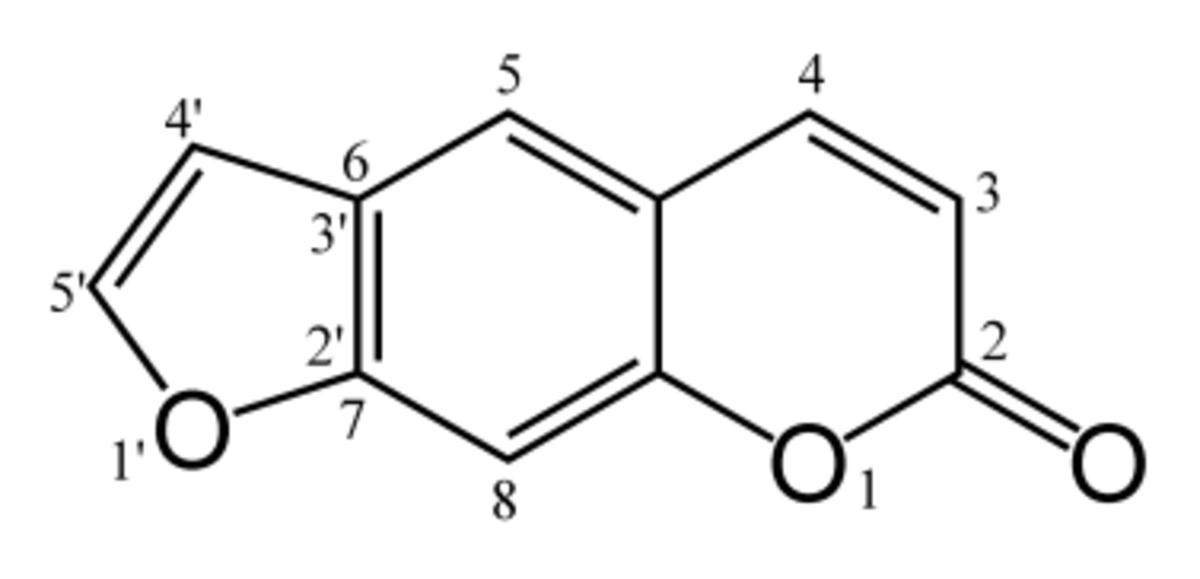
Le psoralène est un composé chimique naturel de la famille des furocoumarines. Sa structure est donc celle des coumarines à laquelle est fusionné un cycle de furane. C'est un dérivé de l'ombelliférone.
Le psoralène est naturellement présent dans les graines de Psoralea corylifolia (babchi), mais aussi dans le figuier commun, le céleri, la berce du Caucase, les arbustes du genre Zanthoxylum et en moins forte concentration dans les agrumes, l'aneth, le persil, le panais et les chrysanthèmes (Rutaceae et Apiaceae). Il est très utilisé en PUVA-thérapie (=psoralène+UVA) contre le psoriasis, l'eczéma, le vitiligo, et des lyphomes cutanés de lymphocytes T. Bien que sans danger mortel pour les mammifères, le psoralène doit être utilisé avec précaution car, comme de nombreuses furocoumarines, il est extrêmement toxique pour les poissons.
Chimie
Un isomère du psoralène est l'angélicine.
Structure
La structure du psoralène, une coumarine fusionné avec un cycle de furane, a originalement été déterminée par des réactions de dégradation; ainsi, il réagit selon les mêmes réactions que le lactone des coumarines, comme l'ouverture du cycle par un alcali pour donner l'acide coumarinique ou un dérivé de l'acide coumarique, et le permanganate de potassium cause l'oxtdation du cycle de furane, tandis que d'autres méthodes d'oxydation produisent d' l'acide furane-2,3-carboxylique.
Synthèse
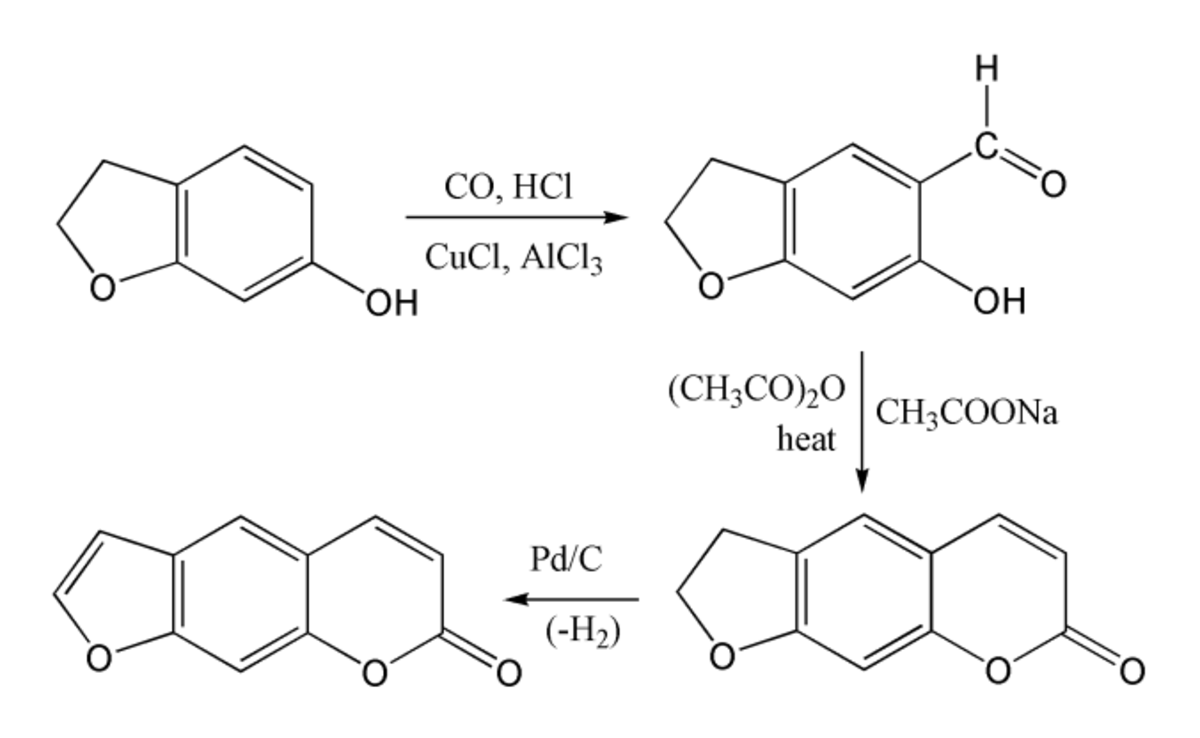
La synthèse du psoralène est difficile, car l'ombelliférone subit plus facilement une substitution électrophile aromatique en position 8 que sur la position 6 désirée. Le benzofurane lui réagit préférentiellement par le cycle de furane que par le cycle de benzène. Par contre, le 6-hydroxy-2,3-dihydrobenzofurane (6-hydroxycoumarane) peut subir un substitution permettant la synthèse du groupe coumarine par réaction de Gattermann-Koch, suivie d'une condensation de Perkin utilisant de l'anhydride acétique. La synthèse se termine par une déshydrogénation du cycle à 5 atomes pour donner le cycle de furane.
Utilisations
Le psoralène est un mutagène et est utilisé dans ce but dans la recherche en biologie moléculaire. Il s'intercale dans l'ADN, et, exposé aux ultraviolets (UVA), Il peut former des ICL covalentes avec les thymines, préférentiellement sur les sites 5'-TpA dans le génome, provoquant des apoptoses. L'utilisation de psoralène, en addition avec une exposition aux UVA (PUVA-thérapie) a montré une efficacité clinique considérable. Une des principales utilisation du psoralène est d'ailleurs la PUVA-thérapie pour traiter les problèmes de peau comme le psoriasis et, dans une moindre mesure, l'eczéma et le vitiligo. Elle tire avantage du haut niveau d'absorption des UV par le psoralène (comme les autres furocoumarines). Le psoralène est d'abord appliqué pour sensibiliser la peau, puis on expose la zone à des UVA pour « nettoyer » le problème de peau. Malheureusement, un effet secondaire de la PUVA-thérapie est un plus grand risque de développement de cancer de la peau.
Le psoralène est aussi utilisé pour traiter l'alopécie.
Malgré ses propriétés photocancérigènes, le psoralène a été utilisé comme activateur de bronzage dans les écrans solaires jusqu'en 1996.