Ombelliférone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Ombelliférone | |
|---|---|
| |
| Général | |
| Nom IUPAC | |
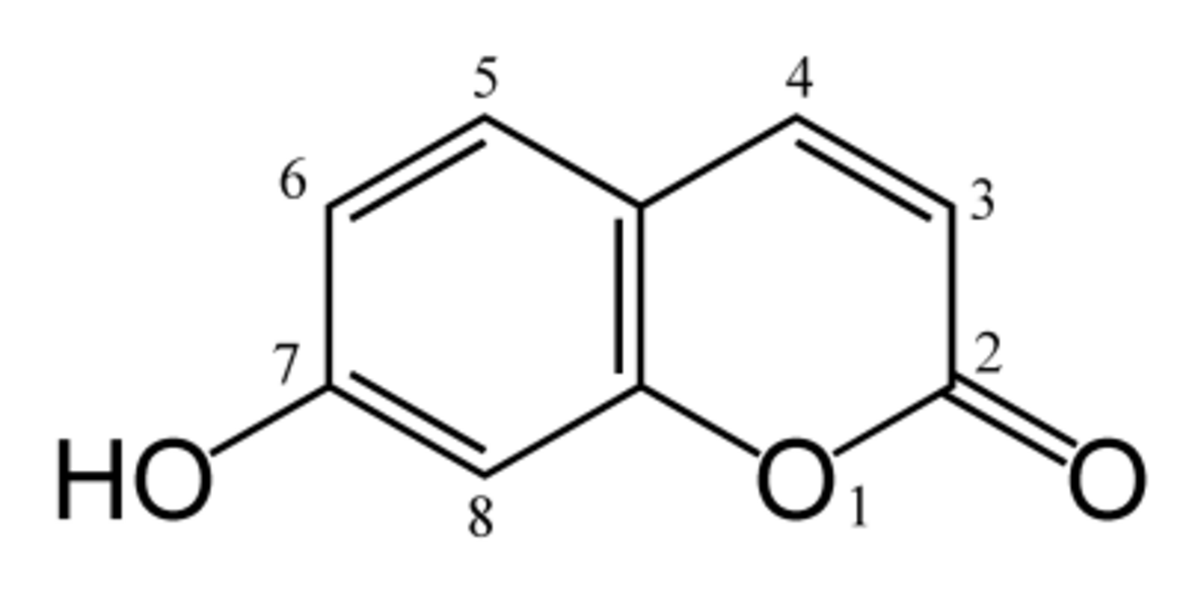
| Synonymes | 7-hydroxycoumarine 7-hydroxybenzopyran-2-one |
| No CAS | |
| No EINECS | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C9H6O3 |
| Masse molaire | 162,1421 ± 0,0085 g·mol-1 |
| pKa | 7,7 (proton phénolique) |
| Propriétés physiques | |
| T° fusion | 230,5 °C |
| Écotoxicologie | |
| DL | 450 mg·kg-1 (souris, i.v.) |
| LogP | 1,030 |
| | |
L'ombelliférone, appelée aussi 7-hydroxycoumarine est un composé organique naturel très répandu de la famille des coumarines. Elle est particulièrement présente dans les plantes de la famille des Apiaceae (appelés aussi Ombellifères), famille comprenant par exemple les carottes, le persil, l'angélique ou encore la grande ciguë.
Propriétés
L'ombelliférone se présente sous la forme d'un solide cristallin blanc-jaune. Elle est très peu soluble dans l'eau même chaude, mais a une grande solubilité dans l'éthanol. Elle absorbe fortement la lumière ultraviolette à certaines longueurs d'onde 300, 305 et 325 nm (avec des valeurs respectives de log ε de 3,9, 3,95 et 4,15). Quand le pH est supérieur à 7,7, l'ombelliférone perd son proton phénolique et cette absorption change. L'ombelliférone présente aussi, tant en lumière ultraviolette qu'en lumière visible, une forte fluorescence bleue.
Utilisations
L'ombelliférone, de par sa capacité à absorber les ultraviolets, peut être utilisée par exemple dans les crèmes solaires, et pour sa capacité à réémettre de la lumière bleue comme agent azurant. Elle a aussi été utilisé comme milieu amplificateur pour les lasers à colorant.
En chimie, l'ombelliférone peut servir aussi en solution à 0,1% d'indicateur fluorescent de la présence d'ions du cuivre et du calcium. Elle peut aussi servir d'indicateur pH grâce à son changement d'absorption fonction du pH.
Synthèse
Biosynthèse
L'ombelliférone est synthétisée dans la nature par cyclisation interne de l'acide paracoumarique.
En laboratoire
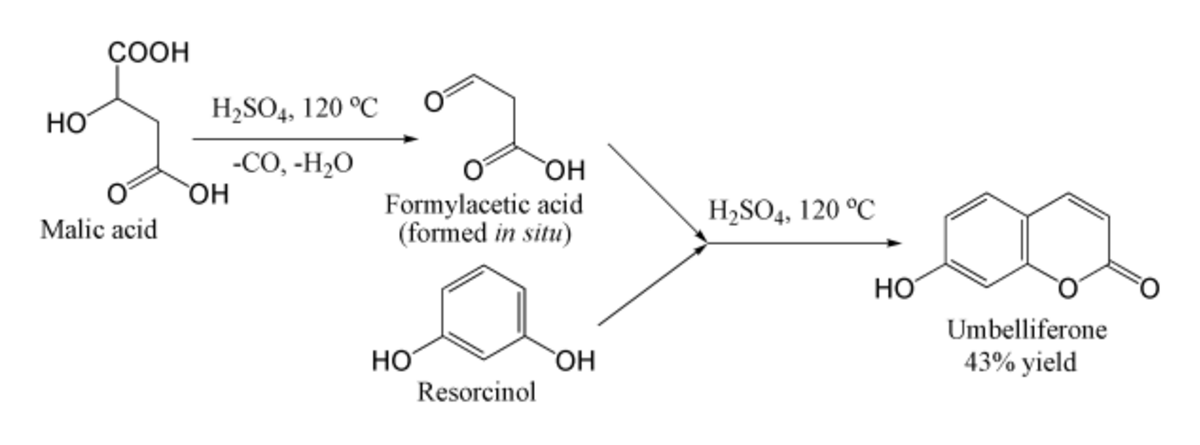
L'ombelliférone est traditionnellement synthétisée en utilisant la condensation de Pechmann, à partir de la résorcine et de l'acide formylacétique (produit in situ à partir de l'acide malique).
Une nouvelle synthèse existe, utilisant le propiolate de méthyle (CH≡CH-C(=O)O-CH3), catalysée par le palladium.
Dérivés
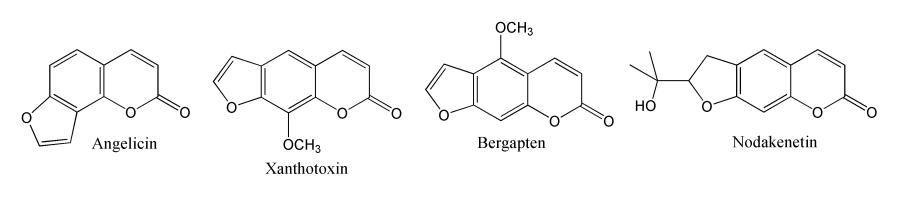
L'ombelliférone possède de nombreux dérivés naturels, comme l'herniarine (7-méthoxycoumarine) présente dans les feuilles de l'herniaria et de l'ayapana triplinervis. On compte aussi des dérivés O-glycosylés comme la skimmine (7-O-β-D-glucopyranosylombelliférone), qui sert par exemple en spectroscopie de fluorescence pour détecter des enzymes glycoside hydrolase. Les dérivés isoprénylés sont aussi courants, comme la marmarine présente dans la peau des grains de raisin et dans l'écorce de l'arbre Bael (aegle marmelos), et les furocoumarines, comme la marmésine (nodakénétine), l'angélicine, l'impératorine, le xanthotoxine, le bergaptène et le psoralène.