Acroléine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acroléine | ||||
|---|---|---|---|---|
| ||||
| Général | ||||
| Nom IUPAC | ||||
| Synonymes | 2-propénal aldéhyde acrylique | |||
| No CAS | ||||
| No EINECS | ||||
| SMILES | ||||
| InChI | ||||
| Apparence | liquide incolore à jaune, d'odeur âcre. | |||
| Propriétés chimiques | ||||
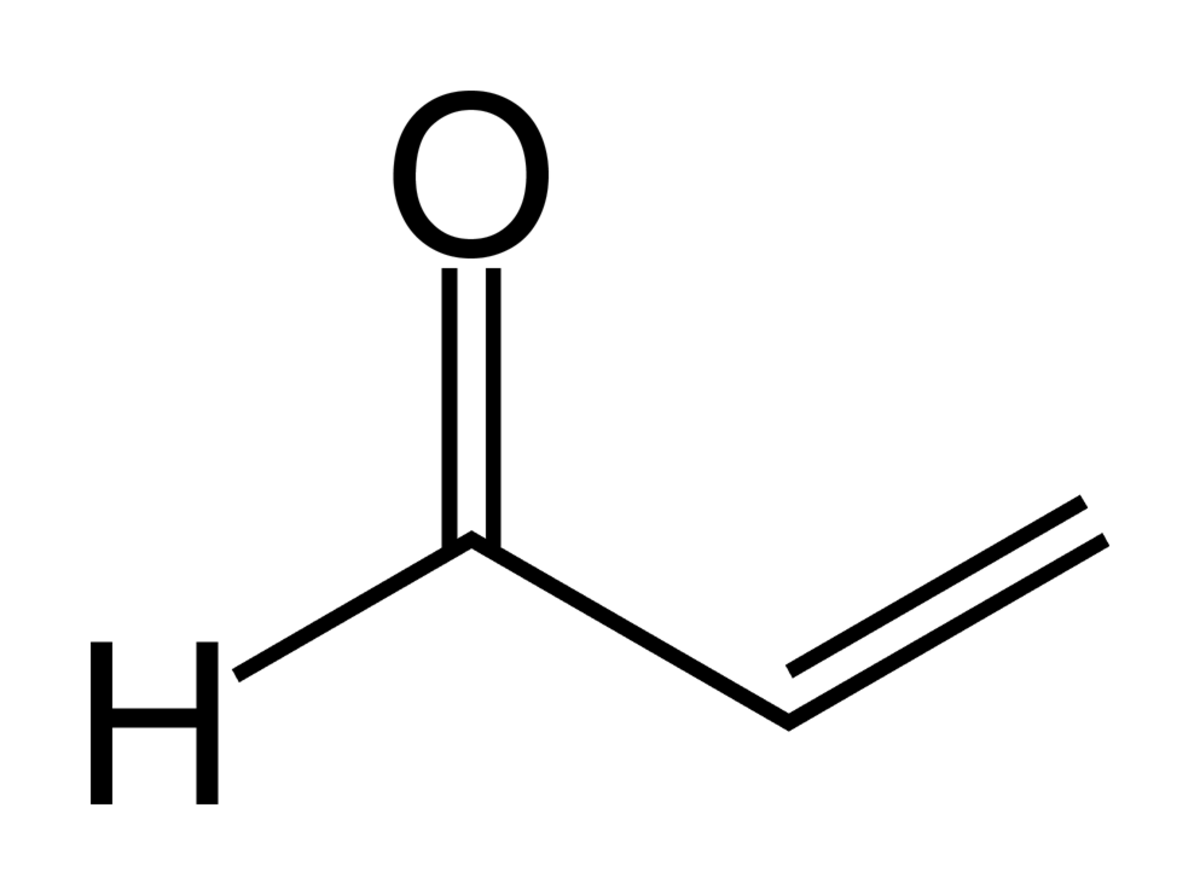
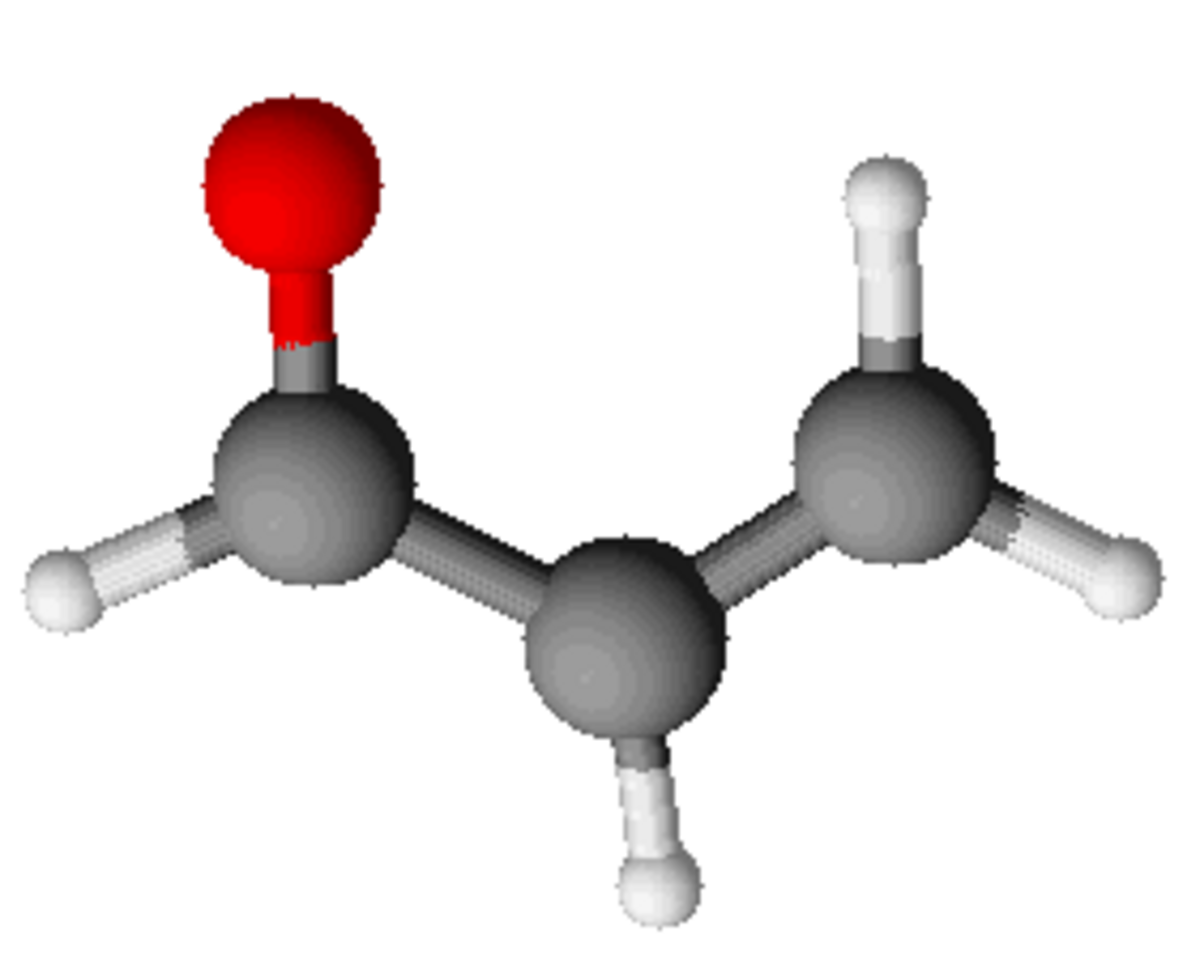
| Formule brute | C3H4O H2C=CH-CHO | |||
| Masse molaire | 56,0633 ± 0,003 g·mol-1 | |||
| Moment dipolaire | 2,552 ± 0,003 D (cis) 3,117 ± 0,004 D (trans) | |||
| Propriétés physiques | ||||
| T° fusion | -88 °C | |||
| T° ébullition | 53 °C | |||
| Solubilité | dans l'eau à 20 °C : 200 g·l-1 | |||
| Masse volumique | (eau = 1) : 0.8, 1,94 (vapeur) | |||
| T° d’auto-inflammation | 234 °C | |||
| Point d’éclair | -26 °C (coupelle fermée) | |||
| Limites d’explosivité dans l’air | 2,8–31 %vol | |||
| Pression de vapeur saturante | à 20 °C : 29 kPa | |||
| Viscosité dynamique | 0,33cP (25 °C) | |||
| Point critique | 51,6 bar, 232,85 °C | |||
| Thermochimie | ||||
| Cp | ||||
| Propriétés électroniques | ||||
| 1re énergie d'ionisation | 10,103 ± 0,006 eV (gaz) | |||
| Précautions | ||||
| | ||||
| ||||
| Phrases R : 11, 24/25, 26, 34, 50, | ||||
| Phrases S : 23, 26, 28, 36/37/39, 45, 61, | ||||
| | ||||
| ||||
| | ||||
|
3 4 3 | ||||
| | ||||



| ||||
| | ||||




Danger | ||||
| | ||||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | ||||
| Écotoxicologie | ||||
| LogP | 0,9 | |||
| Seuil de l’odorat | bas : 0,02 ppm haut : 1,8 ppm | |||
| | ||||
L'acroléine est une substance chimique de formule brute C3H4O aussi connue sous divers noms comme propènal, prop-2-ènal,prop-2-èn-1-al, acraldéhyde, acrylaldéhyde, aldéhyde acrylique, acquinite, aqualin, aqualine, biocide, crolean, éthylène aldéhyde, magnacide, magnacide H ou slimicide.
Elle se présente sous la forme d'un liquide incolore à légèrement jaunâtre. C'est un aldéhyde (H2C=CH-CHO) extrêmement toxique par inhalation et ingestion, elle est le constituant de la papite. Les limites d'exposition atmosphérique de l'acroléine sont de l'ordre de 0,1 ppm (soit 250 microgrammes par mètre cube d'air). L'acroléine est un irritant majeur présent dans la fumée de cigarette ; sa concentration peut varier de 0,006 à 0,120 ppm en atmosphère enfumée.
Elle a pour origine l'incendie de matières plastiques (décès par suffocation), les fruits pourrissants, la décomposition de graisses. Elle se forme lorsque les acides gras présents dans les viandes se dégradent sous l’action de la chaleur (barbecues). Les acides gras à longues chaînes brisent les liens qui les liaient au glycérol, puis la molécule de glycérol perd deux molécules d’eau pour former l’acroléine. Elle contribue aussi au parfum des caramels préparés par chauffage en décomposition partielle du saccharose.