Anhydride arsénieux - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Anhydride arsénieux | |||
|---|---|---|---|

| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Code ATC | L01 | ||
| Apparence | blocs blancs ou transparents ou poudre cristalline. | ||
| Propriétés chimiques | |||
| Formule brute | As2O3 | ||
| Masse molaire | 197,8414 ± 0,0009 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 275 à 313 °C | ||
| T° ébullition | Point de sublimation : 193 °C | ||
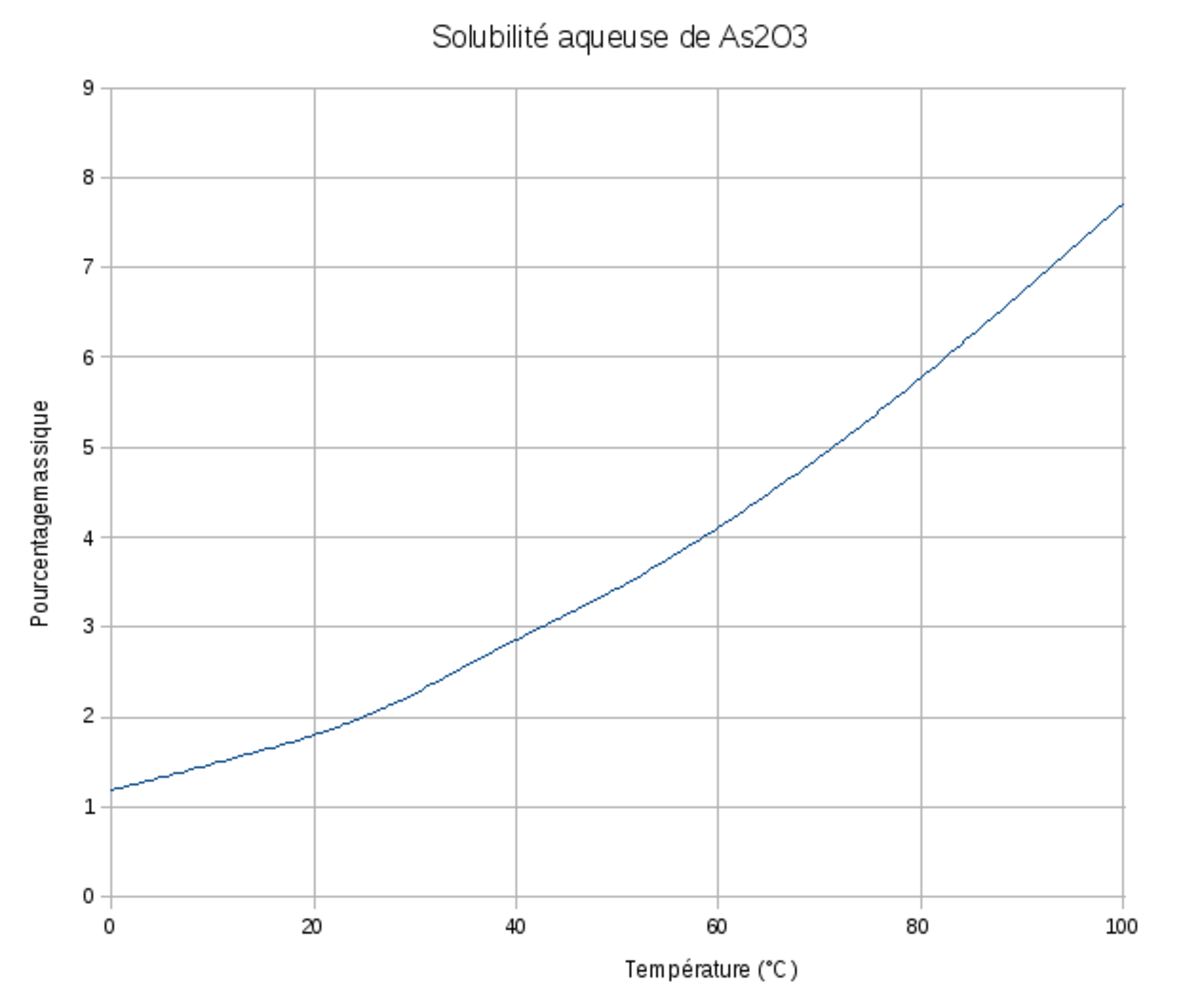
| Solubilité | dans l'eau à 20 °C : 12–37 g·l-1 | ||
| Masse volumique | 3,7–4,2 g·cm-3 | ||
| Pression de vapeur saturante | 0,275 kPa (220 °C) 8,8 kPa (312,3 °C) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 28, 34, 45, 50/53, | |||
| Phrases S : 45, 53, 60, 61, | |||
| | |||
| |||
| | |||

| |||
| | |||



Danger | |||
| | |||
Dans l’industrie, l’anhydride arsénieux (As2O3), ou trioxyde d'arsenic, ou oxyde arsénieux appelé autrefois 'arsenic blanc' (ou même improprement arsenic), sert à blanchir le verre. Il existe à l'état naturel sous le nom de fleur d'arsenic, sous l'aspect d'une poudre blanche inodore ou de cristaux transparents. On le trouve également dans les poisons, tels que la Mort aux rats. Par ses débouchés commerciaux, il représente le composé chimique le plus important dérivé de l'arsenic et s'avère le sous-produit le plus dangereux contenu dans certains minerais comme les mines d'or.
Obtention
- Combustion de l'arsenic dans l'air.
4 As +3 O2 → 2 As2O3
- Hydrolyse du trichlorure d'arsenic AsCl3
- Grillage de minéraux contenant de l'arsenic comme les pyrites.(la source industrielle la plus importante).
2 FeAsS + 5 O2 → Fe2O3 + 2 SO2 + As2O3.
L'anhydride arsénieux s'échappe dans de longues tuyauteries sous forme de fumée volatile que l'on recueille sous forme de poudre blanche. Il est ensuite purifié par sublimation.
Propriétés physiques
Elles varient en fonction de la forme cristalline de la substance. L'anhydride arsénieux se présente sous deux variétés cristallines et une amorphe. Il se sublime au-delà de 200 °C sous forme de As4O6.
- forme cubique: arsenolite, la plus courante.
- forme monoclinique: claudetite.
Propriétés chimiques
L'anhydride arsénieux est un acide amphotère qui présente néanmoins un comportement d'acide faible. Il se dissout instantanément en milieu basique pour donner des ions arsénites : H2AsO3−.
Il est soluble dans la soude:
As2O3 + 4 OH- → 2HAsO32- + H2O
Il est beaucoup moins soluble dans les acides, mais soluble dans l'acide chlorhydrique pour donner du chlorure d'arsenic. Il réagit avec des agents oxydants comme l'ozone, le peroxyde d'hydrogène ou l'acide nitrique pour donner le pentoxyde d'arsenic As2O5. Les réactions avec le peroxyde d'hydrogène peuvent être explosives. Il peut être aussi réduit en arsenic avec formation d'arsine AsH3, gaz très toxique. Il forme un mélange spontanément inflammable avec le chlorate de sodium.