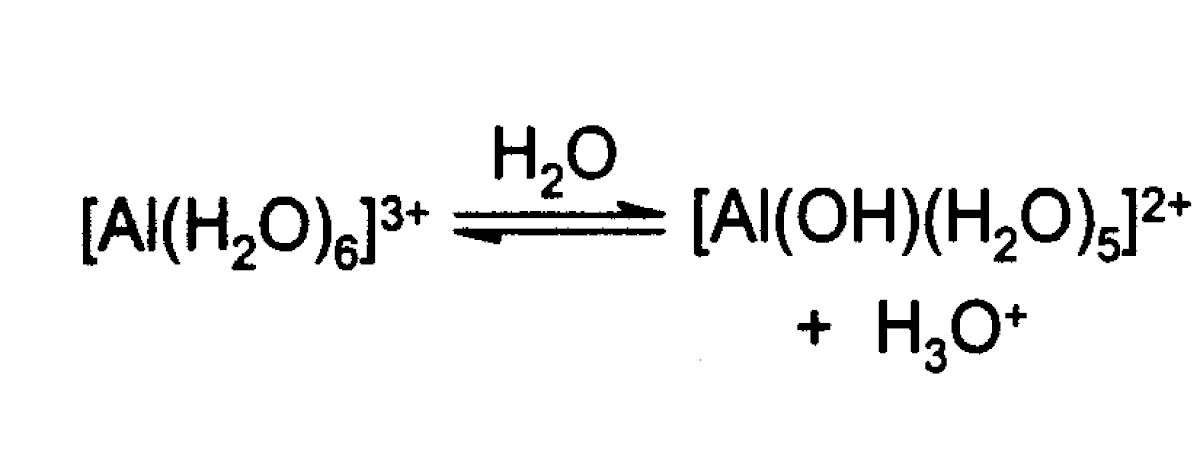Chlorure d'aluminium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| chlorure d'aluminium (III) | ||
|---|---|---|

| ||
| Général | ||
| Synonymes | trichlorure d'aluminium | |
| No CAS | ||
| No EINECS | ||
| Apparence | solide jaune pâle | |
| Propriétés chimiques | ||
| Formule brute | AlCl3 | |
| Masse molaire | 133,341 ± 0,006 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 463 K (190 °C) sous une pression de 2,5 atm | |
| T° ébullition | 351 K (178 °C) (sublimation | |
| Solubilité | dans l'eau : 439 g·l-1 (0 °C), 449 g·l-1 (10 °C), 458 g·l-1 (20 °C) 466 g·l-1 (30 °C) 473 g·l-1 (40 °C) 481 g·l-1 (60 °C) 486 g·l-1 (80 °C) 490 g·l-1 (100 °C). éthanol : 1 000 g·l-1 (12,5 °C). chloroforme : 0,7 g·l-1 (20 °C). CCl4 : soluble. éther : soluble | |
| Masse volumique | 2,40×10³ kg/m³ | |
| Point critique | 26,3 bar, 346,85 °C | |
| Cristallographie | ||
| Système cristallin | réseau hexacoordiné | |
| symbole de Pearson | mC16 | |
| Classe cristalline ou groupe d’espace | C2/m (n°12) | |
| Strukturbericht | D015 | |
| Précautions | ||
| | ||
| ||
| Phrases R : 34, | ||
| Phrases S : (1/2), 7/8, 28, 45, | ||
| | ||
|
0 3 2 | ||
| | ||

Danger | ||
| Écotoxicologie | ||
| DL | 3 450 mg·kg-1 | |
| | ||
Le chlorure d'aluminium (AlCl3) est un sel d'aluminium et de chlore. La forme anhydre possède une structure particulière : bien qu'étant un halogénure d'un métal très électropositif, les liaisons chimiques sont principalement covalentes (et non pas ioniques comme on pourrait s'y attendre. Cela a notamment pour conséquence qu'AlCl3 possède des températures de fusion et de sublimation basses (178 °C pour cette dernière), et qu'à l'état liquide il conduit mal l'électricité contrairement aux halogénures ioniques comme le chlorure de sodium. Ce composé existe à l'état solide sous la forme d'un réseau hexacoordiné. Il fond en formant un dimère tétracoordiné, Al2Cl6 qui peut se vaporiser, mais qui se dissocie à température plus élevée pour former une espèce AlCl3 analogue à BF3.
Le chlorure d'aluminium est très déliquescent, et il peut exploser au contact de l'eau sous l'effet de l'hydratation. Il s'hydrolyse partiellement en présence d'eau pour former du chlorure d'hydrogène et/ou de l'acide chlorhydrique. En solution aqueuse, AlCl3 est totalement ionisé et la solution conduit bien le courant électrique. Cette solution est acide. De manière simplifiée, le cation produit par la réaction du chlorure d'aluminium avec l'eau s'écrit :
AlCl3 est probablement l'acide de Lewis le plus couramment utilisé et parmi les plus puissants. Ce composé possède de très nombreuses applications dans l'industrie chimique, notamment comme catalyseur pour les réactions de Friedel et Crafts, à la fois l'alkylation et l'acylation. Il est également utilisé pour des réactions de polymérisation ou d'isomérisation de composés organiques.
Il existe également un chlorure d'aluminium (I) (AlCl), mais il est très instable et n'est connu qu'à l'état gazeux.