Chlorure d'aluminium - Définition
La liste des auteurs de cet article est disponible ici.
Propriétés physico-chimiques
À l'état solide, le chlorure d'aluminium cristallise suivant la structure type YCl3, avec les ions Al3+ formant un réseau cubique à faces centrées.
Le chlorure d'aluminium est un acide de Lewis puissant, capable de réagir selon des réactions acide-base de Lewis avec des bases de Lewis même faibles comme la benzophénone ou le mésitylène. En présence d'un ion chlorure, il réagit pour former AlCl4-.
L'hydrolyse partielle en présence d'eau forme du chlorure d'hydrogène et/ou de l'acide chlorhydrique. Les solutions aqueuses de chlorure d'aluminium se comportent de la même manière que les solutions d'autres sels contenant des ions Al3+ hydratés. Par exemple, mis en présence de la quantité appropriée de soude, il forme un précipité gélatineux d'hydroxyde d'aluminium :
AlCl3(aq) + 3 NaOH(aq) → Al(OH)3(s) + 3 NaCl(aq)
Utilisations
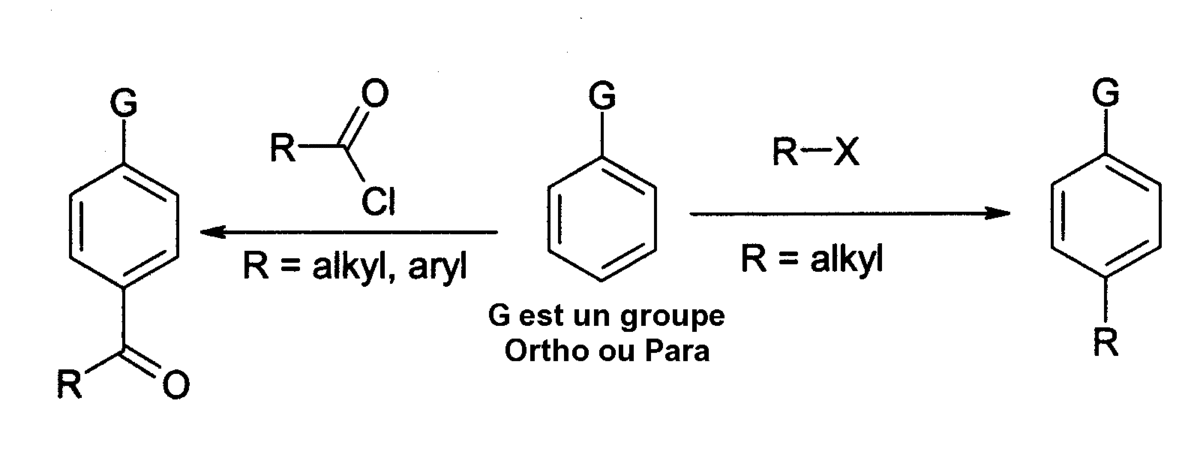
La principale utilisation du chlorure d'aluminium concerne la fabrication de composés par la réaction de Friedel et Crafts dont il est un catalyseur, par exemple la fabrication d'anthraquinone (pour l'industrie de la teinture) à partir du benzène et du phosgène. Au cours de la réaction de Friedel et Crafts, un chlorure d'acyle ou un halogénure d'alkyle réagit avec un composé aromatique suivant :
Avec les dérivés du benzène, le produit principal de la réaction est l'isomère para. La réaction d'alkylation posant de nombreux problèmes, elle est moins largement utilisée que la réaction d'acylation. Dans les deux cas, le chlorure d'aluminium (ou l'appareillage utilisé) ne doit pas être totalement anhydre, des traces d'humidité étant nécessaires pour la mise en œuvre de la réaction. L'un des problèmes de la réaction de Friedel et Crafts est que le catalyseur (chlorure d'aluminium), doit être présent en quantité stœchiométrique pour que la réaction soit totale, parce qu'il forme un complexe stable avec le produit. Cette particularité le rend très difficile à recycler, si bien qu'ils doive être détruit après usage ce qui génère une quantité importante d'effluents corrosifs. Pour cette raison, les chimistes étudient la possibilité d'utiliser des catalyseurs plus neutres vis-à-vis de l'environnement tels que le trifluorométhanesulfonate d'ytterbium (III) ou le trifluorométhanesulfonate de dysprosium (III) qui sont plus coûteux mais peuvent être recyclés.
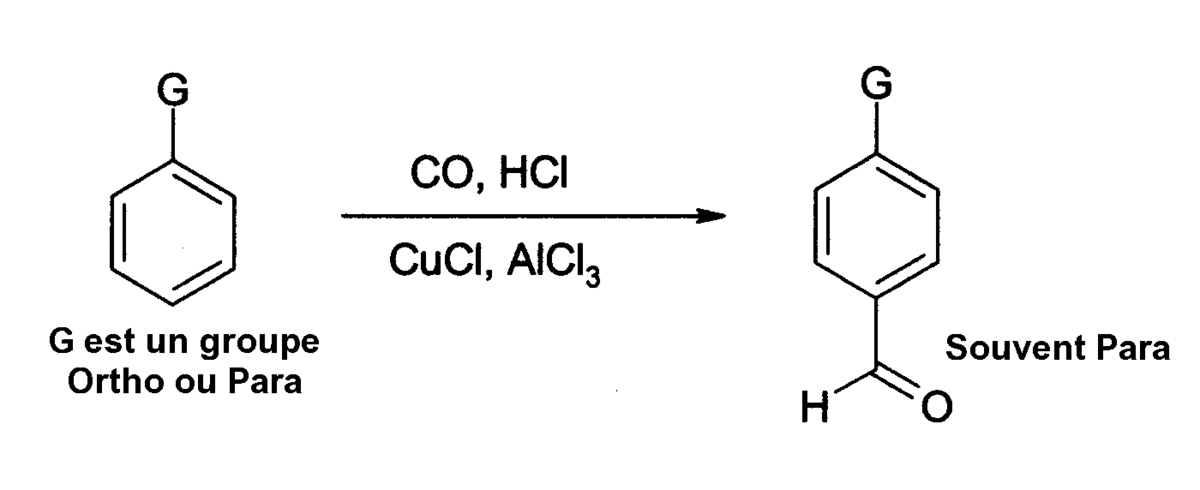
Le chlorure d'aluminium peut également être utilisé dans des réactions d'insertion de fonctions aldéhydes dans des noyaux aromatiques, par exemple suivant une réaction de Gatterman-Koch qui utilise du monoxyde de carbone, du chlorure d'hydrogène et du chlorure de cuivre(I) comme co-catalyseur :
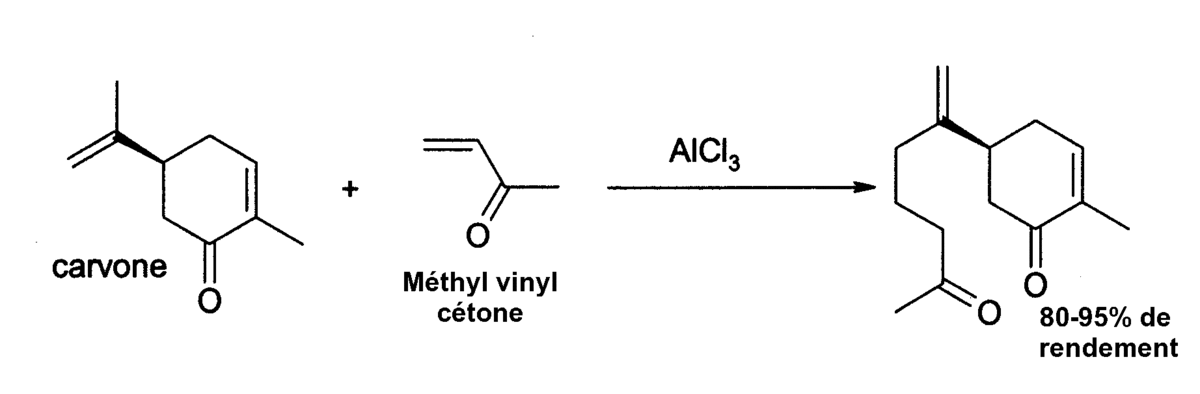
Le chlorure d'aluminium a de nombreuses autres applications en chimie organique. Il catalyse par exemple la réaction de Diels-Alder, comme pour l'addition de 3-butèn-2-one sur le carvone :
AlCl3 est également utilisé dans des réactions de polymérisation ou d'isomérisation de composés organiques. Les applications importantes concernent notamment la fabrication d'éthylbenzène (utilisé pour fabriquer le styrène puis le polystyrène), et la production de dodécylbenzène (utilisé pour fabriquer des détergents).
Préparation
Le chlorure d'aluminium est produit industriellement par la réaction directe des éléments aluminium et chlore.
- 2 Al + 3 Cl2 → 2 AlCl3
Ou à partir d'aluminium et d'acide chlorhydrique
- 2 Al + 6 HCl → 2 AlCl3 + 3 H2
Cette réaction est exothermique.
L'hexahydrate de chlorure d'aluminium
H Al Cl O
Ce produit, stable, n'est pas agressif pour la peau ; il entre même dans la composition de topiques cutanés en dermatologie (voir hyperhidrose).
Principaux synonymes :
- Nom français = Trichlorure d'aluminium hexahydraté,
- Nom anglais = Aluminum trichloride hexahydrate.