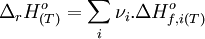Enthalpie de réaction - Définition
La liste des auteurs de cet article est disponible ici.
Approximation courante concernant l'enthalpie de réaction
L'enthalpie d'un corps pur ne peut être calculée de façon absolue car elle dépend de l'énergie interne qui n'est pas calculable ( H = U + pV ). Néanmoins, des tables d'enthalpies molaires ont été établies afin de pouvoir calculer rapidement une enthalpie de réaction à partir des valeurs de ces enthalpies molaires :
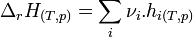
Pour éviter cet inconvénient il a été définie l'enthalpie de formation à T :
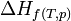
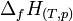
L'enthalpie variant très peu en fonction de la pression, on considère qu'elle est pratiquement indépendante de la pression si cette pression n'est pas très élevée et on prendra alors les valeurs définies dans l'état standard.
L'enthalpie de réaction est définie selon:
Elle est alors appelée enthalpie standard de réaction. L'exposant o fait référence à l'état standard, c'est-à-dire que chaque composé i est pur, sous la pression standard de 1 bar. À noter que si pour un liquide, un gaz ou un solide, la notion de «composé pur» est claire, elle est plus problématique pour un composé dissous en solution (p.ex. sel dissous dans de l'eau), on utilise comme état standard le composé infiniment dilué en phase aqueuse.
Exemples et ordres de grandeur
Valeurs typiques d'enthalpie de réaction:
- Hydrogénation (alcène): -200 kJ/mol
- Amination: -120 kJ/mol
- Neutralisation (acide chlorhydrique): -55 kJ/mol
- Réaction de décomposition (groupe nitro): -350 kJ/mol
Détermination de l'enthalpie de réaction
Il est possible de déterminer l'enthalpie de réaction par mesure expérimentale ou par calcul. Par le calcul, on peut arriver très rapidement à obtenir une valeur approximative à partir des tables thermodynamiques. La mesure expérimentale nécessite un certain savoir-faire et l'utilisation d'un calorimètre ou d'une bombe calorimétrique mais elle permet une détermination plus précise, qui tient notamment compte des conditions réelles de réactions. Elle est de plus bien souvent inévitable pour les composés sur lesquels il n'est pas possible de trouver de l'information dans les bases de données actuelles.
Détermination par le calcul
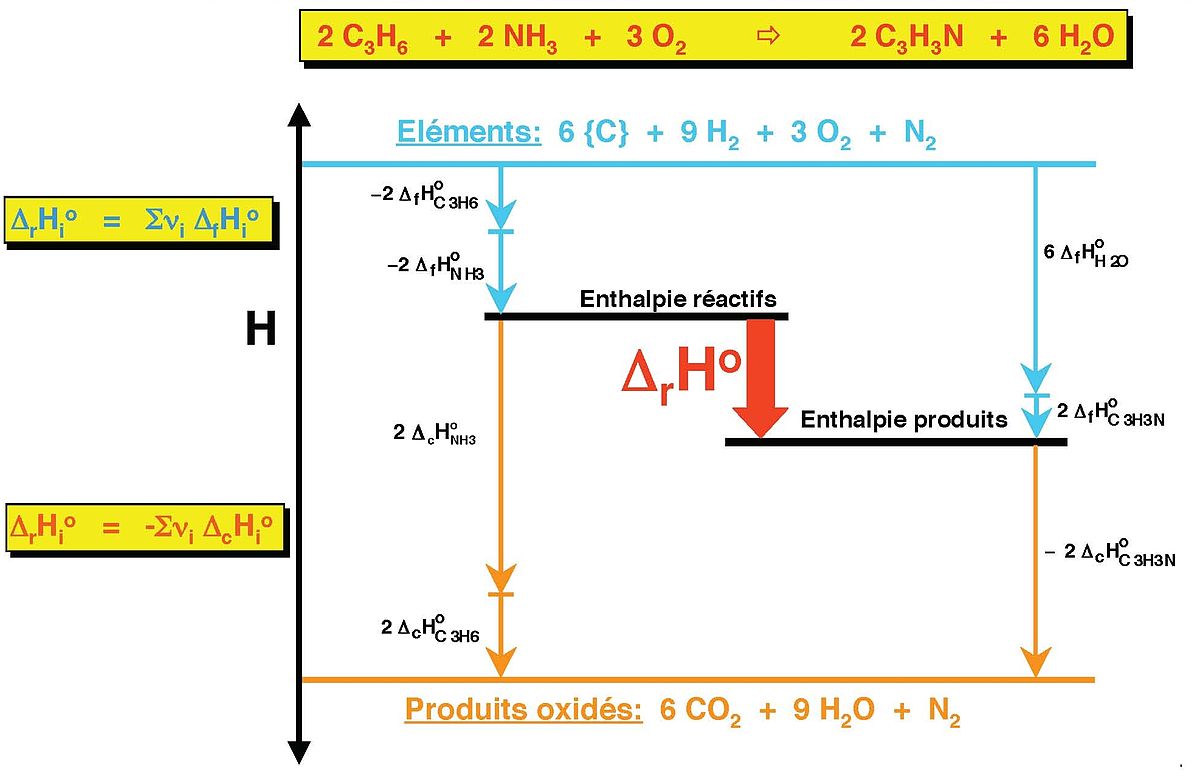
Afin de déterminer une enthalpie de réaction standard par calcul, on utilise généralement les deux états de référence les plus courants, pour lesquels de nombreuses données sont disponibles. Le premier se base sur les enthalpies de formation, qui stipule que l'enthalpie de formation standard d'un corps simple pur, dans sa forme la plus stable, vaut zéro à toutes températures pour lesquelles il est stable. Le second est basé sur les enthalpies de combustion, pour lesquels le niveau zéro a été fixée pour le CO2 ainsi que pour l'eau, qui sont les produits de combustion d'une molécule organique. Les deux méthodes peuvent être combinées (Figure 2).
Afin de déterminer l'enthalpie de formation ou de combustion d'un composé, il est possible de recourir à la loi de Hess en utilisant les données connues.
Il est également possible d'estimer l'enthalpie de formation d'un composé en connaissant sa structure. Cette méthode, dite de Benson, consiste à additionner les contributions enthalpiques des différents groupes fonctionnels de la molécule.
Détermination expérimentale
En l'absence de données thermodynamiques sur un composé, ou afin d'obtenir une détermination plus précise qui tient compte des conditions réelles de réaction, on procède à la détermination expérimentale de l'enthalpie de réaction. Pour cela les méthodes existantes sont:
- Bombe calorimétrique
- Calorimétrie différentielle à balayage
- Calorimétrie de réaction