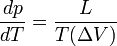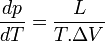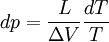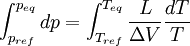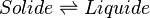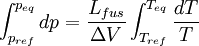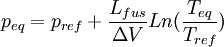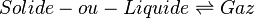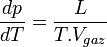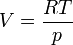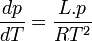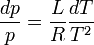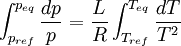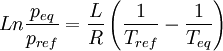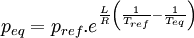Formule de Clapeyron - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La formule de Clapeyron ou relation de Clausius-Clapeyron est une relation permettant de définir l'évolution de la pression d'équilibre en fonction de la température d'équilibre au cours d'un changement d'état physique d'un corps pur. La connaissance expérimentale de cette évolution de la pression en fonction de la température d'équilibre, permet la détermination de la chaleur latente L du changement d'état ou plus généralement du changement de phase.
Expression différentielle de la formule de Clapeyron
-
-
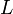
-
-
-
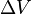
-
Cette formule n'est valable que dans le cas d'une transition de phase du premier ordre (pour les transitions de phase du deuxième ordre voir les formules d'Ehrenfest).
Relations de Clapeyron intégrées
d'où
Considérons deux états d'équilibre dont un état de référence connu, caractérisés par les couples de paramètres: état 1 de référence (pref, Tref); état 2 (peq, Teq). Intégrons la relation de Clapeyron entre ces deux états d'équilibre.
La chaleur latente dépend, en toute rigueur de la température, mais on peut par approximation la considérer comme constante même si l'intervalle de T est de l'ordre quelques dizaines voire quelques centaines de degrés. En revanche la variation de volume ne peut plus être considérée comme constante si l'une des phase est gazeuse. Cela dépend donc du type de changement d'état.
- Équilibre de fusion-solidification
Dans ce cas il n'y a que des phases condensées dont le volume molaire est très faible par rapport à celui des gaz. Donc la variation de volume est très faible et elle reste pratiquement constante entre les deux états d'équilibre. On obtient alors:
d'où
et
|
|
La courbe associée à cette relation correspond à la branche d'équilibre de fusion-solidification, sur le diagramme de Clapeyron: Péq = f(Téq). Cette branche est presque linéaire aux basses pressions et est pratiquement verticale à cause de la faible valeur de la variation de volume constatée pour les phases condensées. Pour la quasi-totalité des composés, la pente est positive. L'eau est une exception (ainsi que le bismuth, l'antimoine, le germanium...) car le volume du solide (glace) est supérieur à celui du liquide ( la glace flotte ) et donc ΔV est négative ainsi que la pente de la branche.
- Équilibre de sublimation-condensation ou vaporisation-condensation
Ces deux équilibres sont caractérisés par la coexistence d'une phase condensée et d'un gaz. Elle correspondent donc au même cas de figure. Comme le volume molaire d'un gaz est très supérieur à celui d'un liquide ou d'un solide, on pourra négliger ce dernier devant le volume du gaz: ΔV ≅ V(gaz). Mais dans ce cas le volume du gaz est très sensible à la pression et la température et il n'est pas possible de négliger sa variation.
Si l'on considère que le gaz se comporte comme un gaz parfait
-
-
-
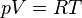
-
-
Donc
Intégrons
D'où
|
|
Cette relation permet d'obtenir les courbes de pression d'équilibre correspondant aux branches de vaporisation et de sublimation sur le diagramme de Clapeyron.