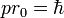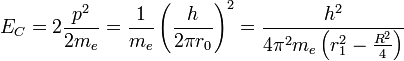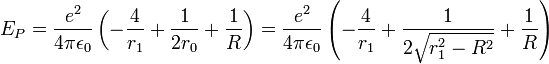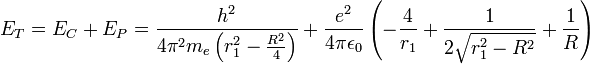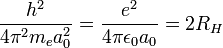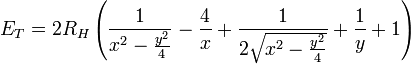Liaison chimique - Définition
La liste des auteurs de cet article est disponible ici.
Calcul de la molécule de dihydrogène
Le premier calcul d'une liaison chimique, fondateur de la Chimie quantique est celui de la molécule la plus simple, celle de l'hydrogène par Bohr en 1913. C'est sans doute le seul calcul de liaison chimique accessible à un non-spécialiste.
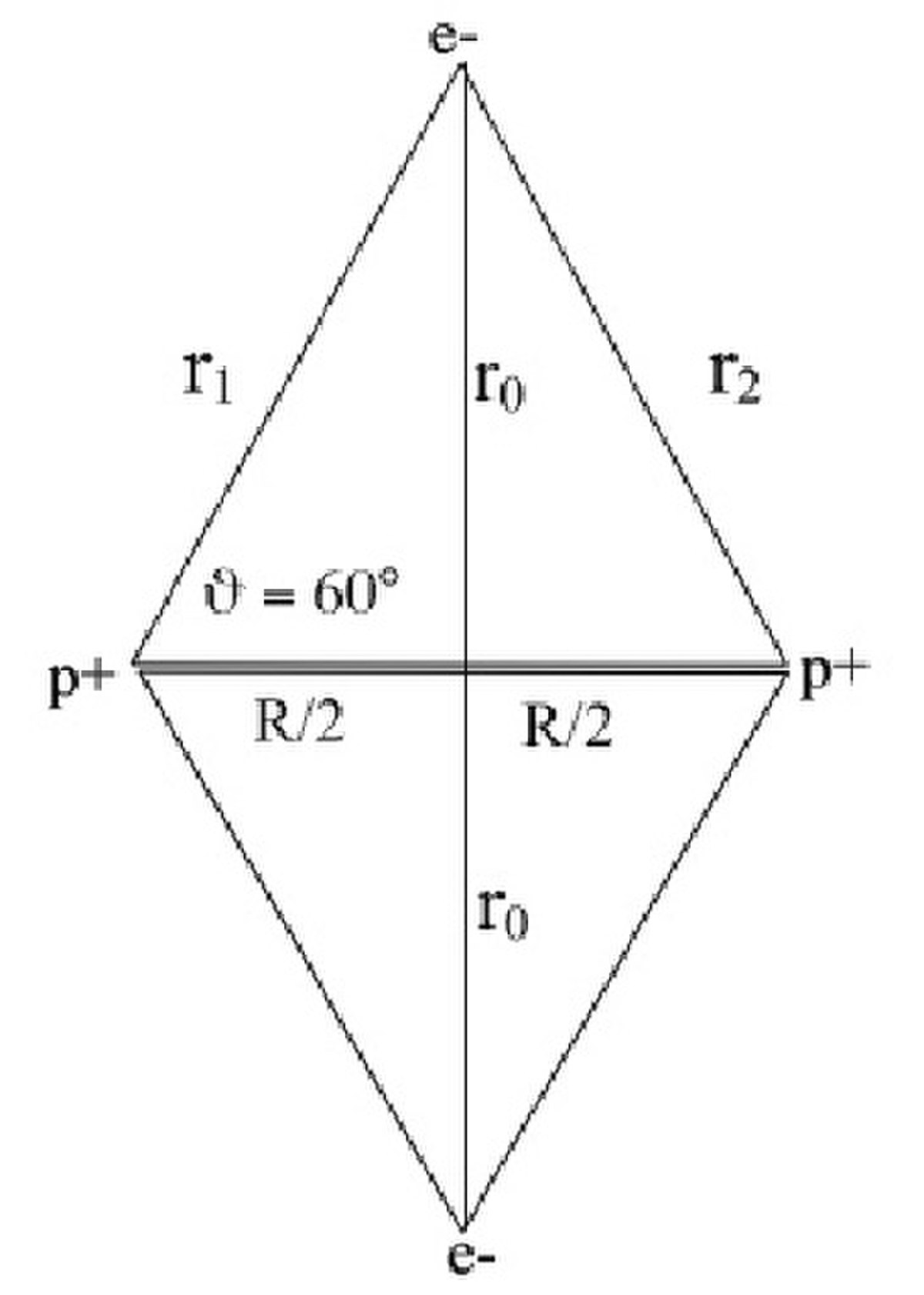
Il consiste à appliquer le modèle de Bohr de l'atome à une molécule. On fait l'hypothèse que les électrons ont un mouvement circulaire de rayon r0 autour de l'axe des protons p+p+, supposés immobiles et distants de R. La distance électron-proton e-p+ est r1. En utilisant la formule du modèle de Bohr de l'atome pour l’état fondamental :
où p=mv est la quantité de mouvement et
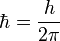
Le potentiel V est attractif entre électrons et protons et se compose des quatre liaisons électron-proton. Il y a répulsion entre les électrons distants de 2r0 et les protons distants de R. L'énergie potentielle s'écrit:
L'energie totale est:
Dans un atome d’hydrogène, l’égalité entre la force électrostatique et la force centrifuge peut s’écrire :
où
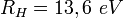
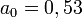
En y retranchant l’énergie de liaison − 2RH de deux atomes d’hydrogène isolés, l’énergie totale de la molécule devient :
où x = r1 / a0 et y = R / a0.
Cette équation se résout graphiquement en faisant varier x de telle façon que l'énergie du minimum soit minimale. On obtient ainsi x = 1,15 et y = 2,7 ce qui donne les valeurs trouvées par Bohr en 1913 de 2,7 eV pour l’énergie de liaison et de 0,6 Å pour l'écartement des protons. La précision du calcul est certes médiocre puisque les valeurs expérimentales sont, respectivement de 4,5 eV et de 0,74 Å. On trouvera des méthodes plus perfectionnées basées sur les orbitales moléculaires.
Histoire
Les premières pensées sur la nature de la liaison chimique depuis le début du XIIe siècle supposaient que certains types d'espèces chimiques étaient liés par certains types d'affinité chimique.
Au milieu du XIXe siècle, Edward Frankland, F.A. Kekule, A.S. Couper, A.M. Boutlerov et Hermann Kolbe, construisant la théorie des radicaux, développèrent la théorie des valences, appelée au départ de "pouvoir de combiner" dans laquelle les composés étaient liés grâce à l'attraction de pôles positif et négatif.
En 1916, le chimiste Gilbert Lewis développa l'idée de la liaison par paire d'électrons. Walter Heitler et Fritz London sont les auteurs de la première explication par la mécanique quantique de la liaison chimique, spécialement celle de l'hydrogène moléculaire, en 1927, utilisant la théorie de liaisons de valence. En 1930, la première description mathématique quantique de la liaison chimique simple fut développée dans la thèse de doctorat de Edward Teller.
In 1931, le chimiste Linus Pauling publia ce qui est parfois considéré comme le texte le plus important de l'histoire de la chimie : “On the Nature of the Chemical Bond”.
Dans ce papier basé sur les travaux de Lewis, Heitler et London, et sur son propre travail, il présente six règles pour la liaison avec électron partagé ; les trois premières étaient généralement connues :
- la liaison par partage d'électrons se forme par l'interaction d'un électron célibataire de chacun des deux atomes
- les spins des deux électrons doivent être opposés
- une fois accouplés, les deux électrons ne peuvent pas entrer dans une autre liaison
Ses trois autres règles étaient nouvelles :
- l'échange d'électrons pour la liaison comprend une seule fonction d'onde pour chaque électron,
- les électrons disponibles dans le niveau d'énergie inférieur forment les liaisons les plus fortes,
- de deux orbitales d'un atome, c'est celle qui peut se superposer le plus à l'orbitale d'un autre atome qui formera la liaison la plus forte.