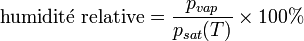Pression de vapeur saturante - Définition
La liste des auteurs de cet article est disponible ici.
Pression de vapeur saturante et autres changements de phase
La pression de vapeur saturante d'une substance en phase liquide peut être — et est généralement — différente de la pression de vapeur de cette même substance en phase solide. Si la température est telle que la pression de vapeur du liquide est supérieure à celle du solide, le liquide se vaporisera mais la vapeur se condensera en un solide, c'est-à-dire que le liquide gèlera. Si la température est telle que la pression de vapeur du liquide est inférieure à celle du solide, le solide se vaporisera mais la vapeur se condensera en un liquide, c'est-à-dire que le solide fondra.
À la température à laquelle les deux pressions de vapeur sont égales, il existe un équilibre entre les phases solides et liquides. Cette température est mentionnée comme le point de fusion.
Cas d'un corps pur solide
La pression de vapeur saturante de la plupart des solides est en général très faible pour des températures proches de l'ambiante (environ 20 °C). Par exemple, la pression de vapeur saturante du fer à 20 °C est tellement faible qu'il est improbable d'avoir un seul atome de fer dans une pièce bien que l'acier présent soit à l'équilibre avec sa vapeur (on entre là dans des considérations quantiques de probabilité de présence).
Par ailleurs, la cohésion des atomes d'un solide fait qu'il est impensable d'avoir un phénomène d'ébullition. Toutefois, il peut se former des pores dans le matériau, et à l'intérieur de cette porosité, une partie solide passe sous forme gazeuse (avec la même précaution que ci-dessus). Cependant, ceci n'est pas lié à la pression atmosphérique comme pour les liquides (sauf pour des pressions extrêmes), mais plutôt aux propriétés du matériau, comme la présence de défauts ponctuels dans un cristal (lacunes) et la tension superficielle.
À partir d'une situation d'équilibre psat(T) = pvap
- modification de la température ambiante :
- modification de la pression ambiante :
- au-dessus de cette pression, la vapeur se condense en solide ;
- en dessous de cette pression, le solide se sublime.
Ainsi, pour une pression donnée, le point de sublimation d'une substance est la température à laquelle la pression de vapeur de cette substance est égale à la pression ambiante.
On n'a donc que trois cas :
- psat(T) > pvap : sublimation
- psat(T) = pvap : équilibre
- pvap > psat(T) : condensation
Pression de vapeur saturante de l'eau dans l'air
Dans le cas de l'eau dans l'air, les manifestations de ce phénomène sont nombreuses : apparition de « vapeur » (en réalité des petites gouttelettes d'eau) au-dessus d'une casserole d'eau chaude, formation de buée, de rosée, de givre, de brouillard, de bruine ou de nuages.
La pression de vapeur saturante de l'air humide représente la quantité maximale de vapeur d'eau que l'air peut contenir. Elle augmente avec la température. On parle souvent du taux d'humidité relative (ou hygrométrie) de l'air : il s'agit du rapport entre la pression partielle de vapeur et la pression de vapeur saturante. Ce taux est exprimé en pourcentage.
| Température (°C) | Pression de vapeur saturante (mbar) |
|---|---|
| -60 | 0,001 |
| -40 | 0,13 |
| -20 | 1,03 |
| -10 | 2,6 |
| 0 | 6,10 |
| 5 | 8,72 |
| 10 | 12,3 |
| 15 | 17,0 |
| 20 | 23,4 |
| 25 | 31,7 |
| 30 | 42,4 |
| 40 | 73,8 |
| 50 | 123 |
| 60 | 199 |
| 100 | 1013 |
La formule de Rankine reprend la précédente avec des coefficients légèrement différents (écart de 0,39 à 4,1 % sur la plage de 5 à 140 °C par rapport aux tables thermodynamiques) :
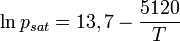
avec :
- psat : pression de vapeur saturante de l'eau, en atmosphère
- T : température absolue, en K
Pour des températures plus élevées, on pourra utiliser la formule de Duperray (écart de 0,12 à 7,7% sur la plage de 90 à 300 °C) :
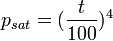
avec :
- psat : pression de vapeur saturante de l'eau, en atmosphère
- t : température, en °C
Il existe d'autres modèles comme la formule de Dupré.