Tension superficielle - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
À la surface d'un milieu dense (liquide ou solide) ou à l'interface entre deux milieux denses, la matière n'est pas, localement, rigoureusement dans le même état. Ce nouvel état local est à une énergie légèrement supérieure. À la surface ou interface est donc associée une certaine énergie par unité de surface (exprimée en joules par mètres carrés — J/m2). Une autre façon d'exprimer la même chose consiste à dire qu'il existe, au voisinage de la surface ou interface, une certaine contrainte en tension dans le milieu ; c'est une force par unité de longueur, exprimée en N/m. On parle donc indifférement d'énergie ou de tension.
On a l'habitude, pour l'interface entre deux milieux denses, de parler de tension interfaciale, d'énergie interfaciale ou d'énergie d'interface. Entre un milieu dense et un gaz, on parle souvent plutôt de tension superficielle, de tension de surface ou d'énergie de surface.
Cet effet permet par exemple aux insectes de marcher sur l'eau, à un objet léger de se maintenir à la surface d'un liquide (illustration ci-contre), à la rosée de ne pas s'étaler sur les pétales de fleurs, et explique la capillarité. La tension superficielle explique aussi la formation des bulles de savon et la coalescence des gouttes ou des bulles.
Exemples simples et expériences
Un certain nombre d'expériences simples permettent de mettre en évidence la tension superficielle.
Forme d'une goutte
Dans le cas d'une goutte d'un liquide A au sein d'un liquide B, l'énergie est minimale lorsque la surface est minimale. Or, la forme correspondant à la plus petite surface possible est une sphère. C'est pour cela que les gouttes d'eau ont une forme sphérique. En réalité, la gravité joue également pour déterminer la forme de la goutte. Voir l'article sur les gouttes.
Coalescence de deux gouttes
Si deux gouttes se rencontrent, elles vont fusionner et ainsi former une seule goutte (coalescence), toujours pour minimiser l'énergie totale, produit de la tension superficielle par la surface totale. En effet, la surface totale du liquide est ainsi amoindrie.
Exemple de calcul pour deux gouttes de même rayon R.
Leur volume est proportionnel au cube R3 de leur rayon. Le volume de la goutte résultante est donc proportionnel à
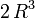
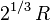
Leur surface est égale à
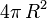
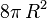
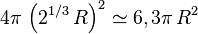
Ainsi, la goutte résultante a une surface moindre que les deux gouttes initiales.
Ménisque de l'eau dans un verre
Lorsque l'on met de l'eau dans un verre, elle remonte d'environ un millimètre le long de la paroi ; ceci est particulièrement visible dans le cas d'un tube à essai (environ 1 cm de diamètre). C'est ce que l'on appelle un ménisque. À l'inverse, il est possible de faire dépasser la surface de l'eau du bord du verre sans qu'elle ne s'écoule en dehors de celui-ci.
Goutte qui pend sans tomber
C'est la tension superficielle qui retient la goutte au support ; la masse de la goutte qui tombe d'un compte-goutte est donnée par la loi de Tate
Action de la tension superficielle sur un fil souple

- Couper une bouteille en plastique,
- Poncer son bord de manière à faire disparaître les imperfections de la découpe,
- Percer deux trous diamétralement opposés à 5 mm du bord,
- Placer un fil légèrement détendu en travers de l'ouverture,
- Poser l'ouverture dans un récipient contenant de l'eau dans laquelle on a dilué un peu de liquide vaisselle, afin de créer une bulle,
- Rompre la partie inférieure de la bulle pour montrer que la force de tension superficielle qui minimise la partie supérieure est assez grande pour soulever le fil.
Propulsion à l'huile ou au savon

- Découper une pièce de plastique d'environ 3 cm (la colorer la rend plus facilement visible).
- Y découper une fente d'un millimètre de large.
- La poser sur l'eau d'un récipient.
- Déposer une goutte d'huile ou de savon liquide dans la fente. La pièce est propulsée par la force de tension superficielle.
On ne peut rééditer l'expérience sans changer l'eau contenue dans le récipient, car une seule goutte de liquide vaisselle abaisse tellement sa tension superficielle qu'une deuxième goutte ne peut à nouveau la diminuer suffisamment.
Fontaine de soda
Dans un soda, les molécules du gaz carbonique dissout sont solvatées, les molécules d'eau forment un bouclier autour du CO2 ; si l'on secoue la bouteille, on vainc la tension superficielle du bouclier et les molécules de CO2 se regroupent pour former des bulles ; ou bien en utilisant une poudre, les petits grains abaissent la tension superficielle, on peut par exemple mettre des chewing-gums (on obtient ainsi l'Effet geyser du mélange Mentos-boisson gazeuse).
Autres phénomènes
- Un liquide peut monter dans un tube fin : loi de Jurin




















































