Propellane - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
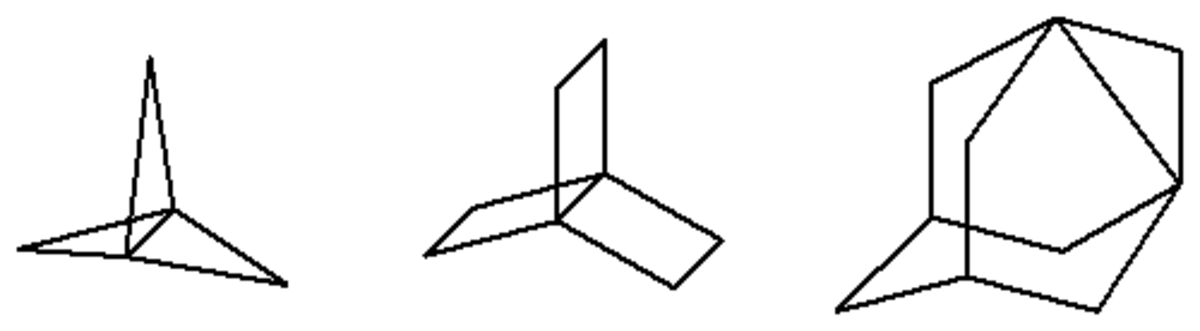
Les propellanes sont une classe d'hydrocarbures saturés ou alcanes tricycliques c'est-à-dire avec deux atomes de carbone tête de pont et quatre branches qui les relient dont une branche ne comportant aucun atome. Ils sont définis et nommés [m.n.p]propellane en référence à leur nom systématique, tricyclo[m.n.p. 01,m+2]alcane, avec le terme propellane qui dérive de l'anglais «propeller», du fait de leur ressemblance avec une «hélice» et avec le suffixe ane des alcanes.
Ils sont caractérisés, pour les plus petits d'entre eux, par la présence d'une géométrie dite en tétraèdre inversé (pyramidale) sur les carbone en tête de pont et donc par de fortes contraintes angulaires et stériques qui les rendent très réactifs. C'est pour ces raisons qu'ils sont beaucoup étudiés par la chimie organique. Les plus simples propellanes sont le [1.1.1]propellane (C5H6) et [2.2.2]propellane (C8H12).
Les propellanes sont une classe particulière de paddlanes pour lesquels une branche est égale à zéro : [m.n.o]propellane = [m.n.o.0]paddlane.
les 1,3-déshydroadamantanes sont de fait des [3.3.1]propellanes de la famille de l'adamantane
Liaison
La liaison carbone-carbone centrale du [1.1.1]propellane qui connecte deux carbones de symétrie pyramidale a une longueur de 160 pm (154 pm pour une liaison C-C non contrainte). L'énergie de cette liaison est encore disputée et varie de 270 -250 kJ/mol (59–65 kcal/mol) à 0, c'est-à-dire totalement non liante. Cependant, l'énergie du biradical est calculé être 335 kJ/mol (80 kcal/mol) plus haut. Récemment, le type de cette liaison dans cette molécule est expliqué en termes de "charge-shift bonding".
[2.2.2]propellane
La synthèse de l'homologue suivant, le [2.2.2]propellane par le groupe de Philip Eaton, célèbre pour sa synthèse du cubane, précède celle du [1.1.1]propellane (1973). La synthèse (schéma 3) consiste en deux réactions de réarrangement de Wolff.
-
 Schéma 3. Synthèse du squelette du [2.2.2]propellane
Schéma 3. Synthèse du squelette du [2.2.2]propellane
Ce propellane est aussi instable. À température ambiante, son temps de demi-vie par rapport à son isomérisation en l'amide alicyclique 3.11 est de 28 minutes. Son énergie de contrainte est estimée à 390 kJ/mol (93 kcal/mol).
[1.1.1]propellane
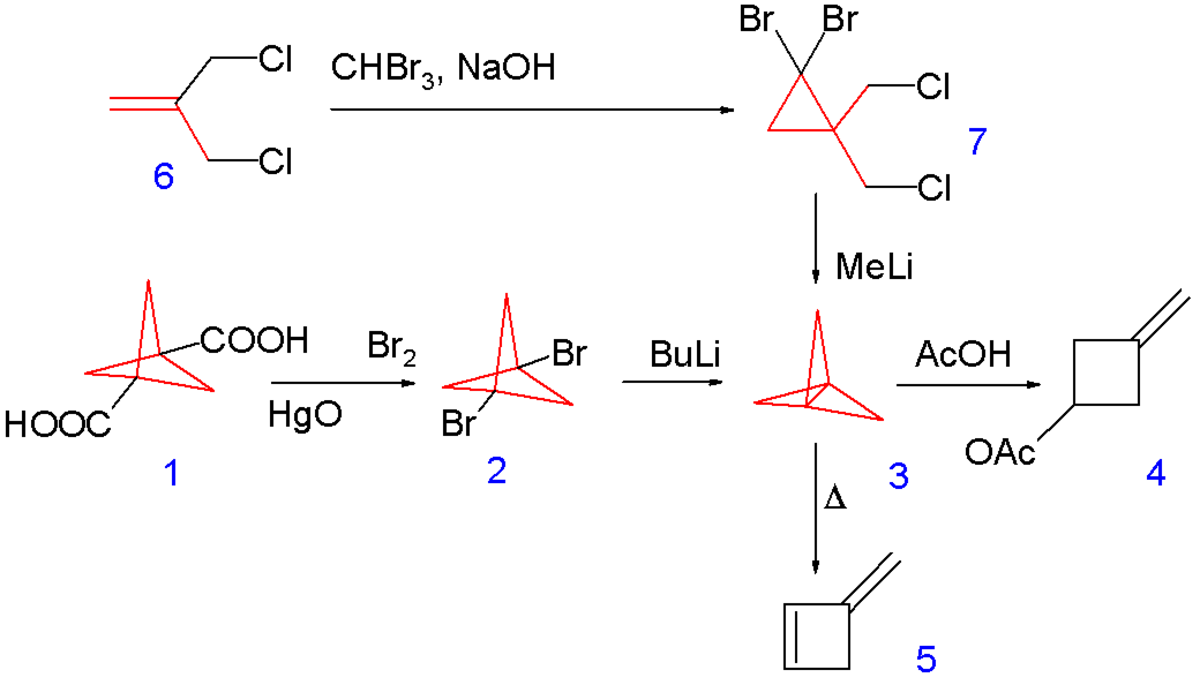
Le [1.1.1]propellane a été synthétisé pour la première fois en 1982 en convertissant le 1,3 diacide carboxylique du bicyclo[1.1.1]pentane 1.1 via une réaction de Hunsdiecker (en) en le dibromure correspondant 1.2 suivie d'une réaction de couplage avec le n-butyllithium comme représenté sur le schéma 1. Le produit est isolé par chromatographie sur colonne à -30°C (!)
une autre voie de synthèse commence avec l'addition du dibromocarbène sur la double liaison du 3-chloro-2-(chlorométhyl)propène 1.6 suivie par une déprotonation avec le méthyl lithium et une substitution nucléophile dans 1.7 qui n'est pas isolé mais gardé en solution à −196 °C.
L'instabilité de ce propellane est mise en évidence par son isomérisation thermique en 3-méthylène cylobutène 1.5 (à 114 °C avec un temps de demi-vie de 5 minutes) et par sa réaction spontanée avec l'acide acétique vers un cyclobutane 1.4.
L'énergie de contrainte est estimée à 427 kJ/mol (102 kcal/mol).
Polymérisation
Le [1.1.1]propellane est un monomère pour la réaction de polymérisation vers les [n]staffanes . Une polymérisation radicalaire initiée par le formiate de méthyl et l'anhydre benzoïque peroxyle forme une distribution d'oligomères (schéma 2) mais une polymérisation par "addition anionique" avec le n-butyllithium forme un vrai polymère. La diffraction X de ce polymère montre que la liaison C-C qui connecte les monomères n'est longue que de 148 pm.