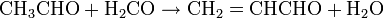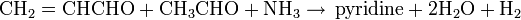Pyridine - Définition
La liste des auteurs de cet article est disponible ici.
Historique
La pyridine a été découverte en 1851 par le chimiste Thomas Anderson grâce à des études sur la distillation de l’huile d’os et de matières animales. Le mot pyridine provient du grec "pyr" le feu et "idine" est le suffixe utilisé pour les bases aromatiques. La pyridine ainsi que plusieurs pyridines alkylées ont ainsi été obtenues au début par la pyrolyse des os grâce à une condensation entre l’ammoniac et les aldéhydes ou les cétones, produits par la décomposition du glycérol et des dérivés azotés contenus dans les ossements. La pyridine peut aussi être obtenue par distillation du charbon, du goudron de charbon d’os, le goudron de houille et le goudron à distillation lente, dans les huiles pyrogénées d’origines diverses, (les huiles des schistes bitumineux ainsi que l’huile de café contiennent de la pyridine). La pyridine est ensuite récupérée par lavage de goudron de houille au moyen d’acide sulfurique dilué, la séparation étant ensuite effectuée à l’aide d’alcalins. La structure de la pyridine a été établie en 1869-1870 par Wilhelm Körner et James Dewar. La découverte de la structure de la pyridine a permis le développement de plusieurs voies de synthèse : en 1877, William Ramsey réalise la synthèse de la pyridine à partir d’acétylène et d’acide cyanhydrique. Puis en 1882, Arthur Hantzsch réalise lui aussi une synthèse de la pyridine. Cependant, la pyridine est restée très peu utilisée pendant des décennies et les petites quantités de pyridine utilisées étaient obtenues par distillation du charbon. La pyridine est devenue importante dans les années 1930 avec la découverte de la niacine (vitamine B3), qui prévient les démences. Depuis les années 1940, la 2-vinylpyridine est utilisé dans la synthèse de latex. La demande en pyridine n’a cessé d’augmenter jusqu’à nos jours grâce à la découverte de nombreuses biomolécules pyrimidiques. )
Propriétés physico-chimiques
La pyridine est un liquide dans les conditions normales de pression et de température. La pyridine est miscible avec l’eau et avec la plupart des solvants organiques habituels. La pyridine est une molécule de polarité moyenne, moins polaire que l’eau et les alcools mais plus polaire que l’acétate d'éthyle, le dichlorométhane, l’éther de pétrole et les alcanes. En RMN du proton, la pyridine se présente sous trois pics : 8,5 ppm pour les hydrogènes en α de l’azote, 7,6 ppm pour les hydrogènes en γ et 7,2 ppm en β. En RMN du carbone, la pyridine est encore sous trois pics : à 150 ppm pour les carbones 1 et 5, 139 ppm pour le carbone 3 et 123 ppm pour les carbones 2 et 4. En spectroscopie infrarouge, la pyridine présente une bande d’absorption autour de 3 000 cm-1 pour les C-H des carbones sp2. Le seuil de détection olfactif est de 0,02 ppm (dans l’air). L’indice de réfraction est de 1,510. La constante diélectrique à 25 °C est de 12,4.
Synthèse de la pyridine
Synthèse industrielle
Synthèse utilisant des aldéhydes ou des cétones avec l’ammoniac
La synthèse à partir d’aldéhydes et/ou de cétones et d’ammoniac est le mode de production de la pyridine le plus courant. L’intérêt de ce type de réaction est l’accès à des réactifs bon marché. La réaction a lieu généralement en phase gazeuse à des températures comprises entre 350 °C et 550 °C en présence d’un catalyseur (composé de silice et d’alumine additionnée d’un métal) et avec un temps de passage dans le réacteur très court, de l’ordre de quelques secondes. Les rendements peuvent atteindre les 60-70%.
La réaction la plus utilisée est la condensation entre l’acétaldéhyde et le formaldéhyde en présence d’ammoniac. Cette réaction se déroule en deux étapes :
- Formation de l’acroléine
-
- Réaction de l’acroléine avec l’acétaldéhyde en présence d’ammoniac
-
Le mélange d’acétaldéhyde, de formaldéhyde et d’ammoniaque est d’abord préchauffé puis passe dans un réacteur à lit fixe contenant le catalyseur à une température de 400 à 450 °C. Le mélange réactionnel est ensuite refroidi afin de séparer les gaz (hydrogène et ammoniaque principalement) des condensats. Une extraction liquide-liquide permet ensuite d’extraire la pyridine et ses dérivés avant qu’une série de colonnes de distillation sépare le solvant d’extraction, la pyridine puis les dérivés plus lourds. Le catalyseur est régulièrement régénéré par le passage d’un flux d’air.
Le rendement en pyridine est de l’ordre de 38-63% en fonction du catalyseur utilisé. Le principal co-produit est la 3-méthylpyridine (rendement entre 9 et 29 %). Si on utilise directement de l’acroléine avec de l’ammoniaque, on favorise la synthèse du 3-méthylpyridine avec un rendement de 15-49%. Et si on utilise uniquement de l’acétaldéhyde avec de l’ammoniaque, on produit préférentiellement 2-méthylpyridine et le 4-méthylpyridine avec un rendement de 35-45% et de 9-44% respectivement selon le catalyseur utilisé.
Déalkylation des alkylpyridines
Les dérivés de la pyridine étant des co-produits facilement vendables, une grande sélectivité n’est pas recherchée durant la synthèse. Toutefois il arrive qu’une part importante des dérivés ayant une valeur trop faible sur le marché soit produite. Dans ce cas, on convertit ces derniers en pyridine par déalkylation oxydative. Les co-produits mélangés avec de l’air ou de l’hydrogène en présence d’eau sont convertis en pyridine avec des rendements compris entre 50 et 93 % en fonction des dérivés et des catalyseurs.
Synthèse utilisant des nitriles et l’acétylène
Une autre voie de synthèse est la réaction entre un nitrile et l’acétylène en phase liquide avec un catalyseur au cobalt et permet un rendement d’environ 50% pour la pyridine. La température de réaction se situe entre 120 °C et 180 °C à une pression comprise entre 0,8 et 2,5 MPa. Cette voie de synthèse est toutefois utilisée pour la production sélective de pyridines ortho-substituées. Ainsi l’acétonitrile et l’acétylène réagissent en présence de cobaltocène pour donner la 2-méthylpyridine avec un rendement de 76 %. L’acrylonitrile réagit avec l’acétylène en présence de (cyclopentadiényl)cobalt-1,5-cyclooctadiène pour donner la 2-vinylpyridine avec un rendement de 93 %.
Synthèse de laboratoire
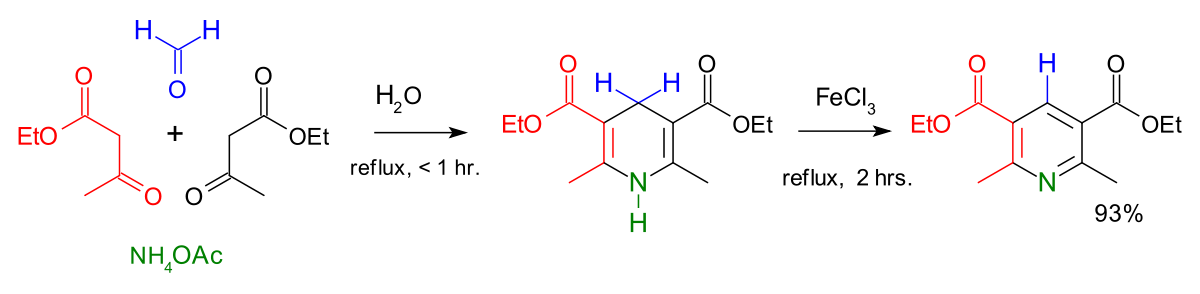
La synthèse de Hantzsch est une autre méthode classique pour obtenir des dérivés de la pyridine. On fait réagir deux équivalents d'un composé 1-3 dicarbonylé (ici l'éthylacétoacétate) avec un équivalent d’ammoniac et un équivalent d’un aldéhyde comme le formaldéhyde pour former une dihydropyridine substituée (cycle ne comportant que deux doubles liaisons). L’action d’un oxydant doux sur cette dihydropyridine permet d’obtenir une pyridine substituée. La synthèse s’effectue à 25 °C et dure plusieurs jours. Les pyridines obtenues sont substituées de façon symétrique.
Un moyen d’obtenir une pyridine dissymétrique est de faire réagir une 3-aminoénone avec un composé 1,3-dicarbonylé. La 3-aminoénone attaque une des fonctions carbonyle du composé 1,3-dicarbonylé pour ensuite donner une imine qui cyclise la molécule en réagissant avec l’autre carbonyle. Au cours de la réaction, deux molécules d’eau sont éliminées. Une pyridine peut être aussi synthétisée à partir d’un composé 1,5-dicarbonylé avec de l’ammoniac pour former une dihydropyridine facilement oxydable en pyridine.