Pyridine - Définition
La liste des auteurs de cet article est disponible ici.
Aromaticité
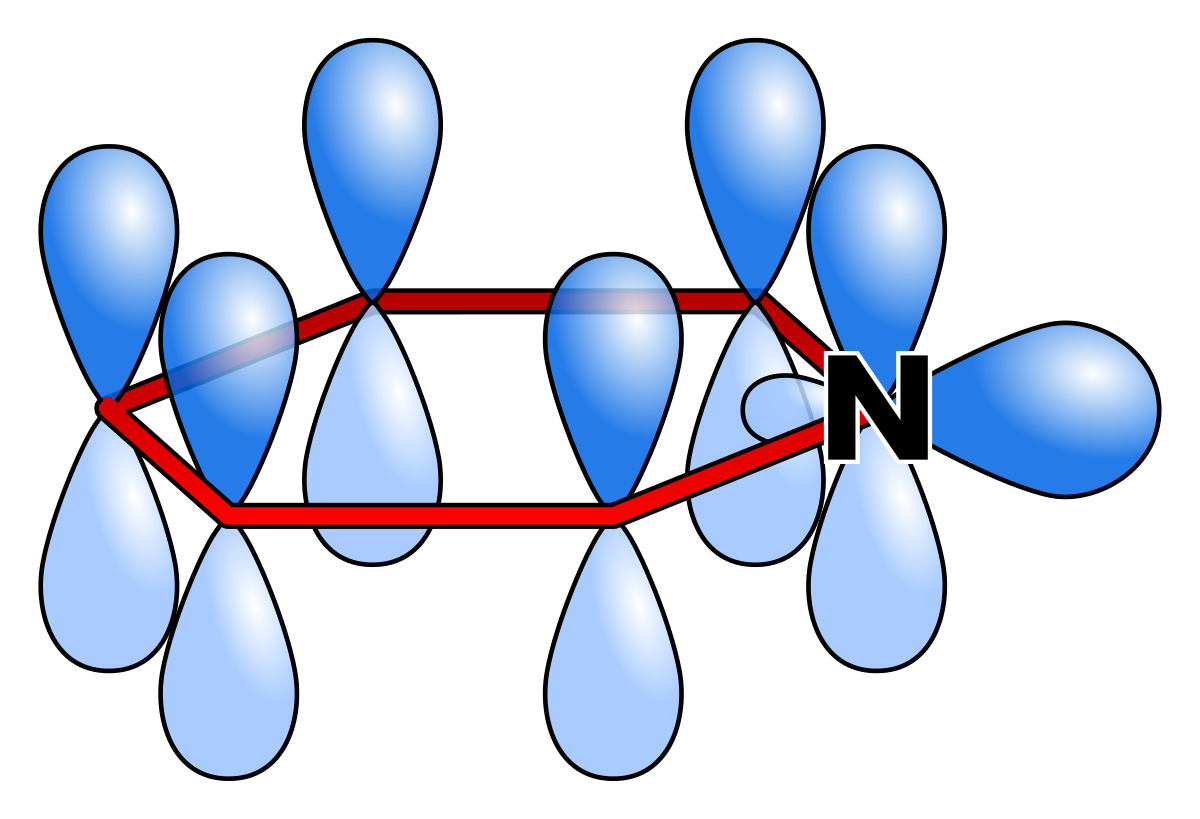
La pyridine est un composé aromatique qui vérifie la règle de Hückel. Les électrons délocalisés sont ceux des trois doubles liaisons soit six électrons. Chaque carbone apporte un de ses électrons pi dans la délocalisation et l’azote également hybridé sp² apporte le sixième électron. La pyridine possède une énergie de résonance de 117 kJ par mole, inférieure à celle du benzène mais supérieure à celles du thiophène, du pyrrole et du furane.
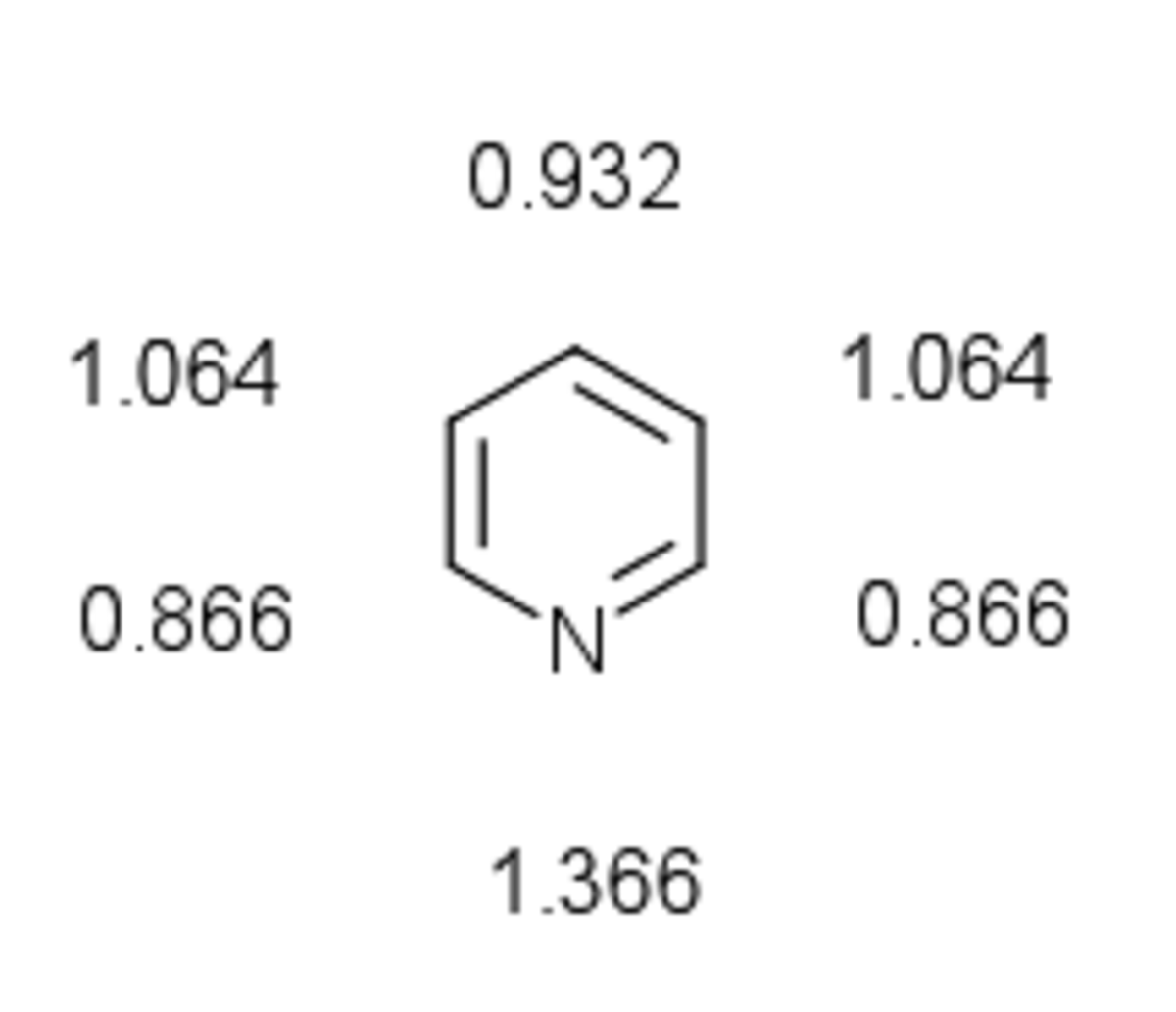
Toutes les liaisons carbone-carbone sont de même longueur (139 pm), intermédiaire entre la longueur d'une liaison C-C simple (154 pm) et d'une liaison double C=C (134 pm). Les deux liaisons carbone-azote ont la même longueur (137 pm), plus courte qu'une liaison simple C-N (147 pm) et plus longue qu'une liaison double C=N (128 pm). La pyridine n’est pas un composé absolument plat à cause de la géométrie des liaisons de l’azote. L’atome d’azote possède un doublet électronique libre équatorial, non délocalisé dans le système π aromatique. La paire libre de l’azote est dans une orbitale sp² dans le plan de la molécule. Seul un électron dans l’orbital p complète l’arrangement électronique de manière à rendre le cycle aromatique.
L’azote ne fait donc pas jouer son caractère mésomère donneur, et seul son caractère inductif attracteur influence le reste du système p. L'atome d’azote exerce donc dans le cycle un effet inductif attracteur et mésomère attracteur. L’azote n’apporte pas de densité électronique supplémentaire. Un effet mésomère attracteur oriente la délocalisation des charges électroniques et affecte une charge électronique sur l’azote dans les quatre formes limites de la pyridine.
L'atome d'azote de la pyridine peut être protoné par réaction avec des acides et forme un cation aromatique appelé ion pyridinium. Le nombre d’électrons délocalisés dans l'ion pyridinium est le même que pour la pyridine, soit six électrons. La charge positive de ce cation est alors stabilisée sur tout le cycle par effet mésomère. L’ion pyridium est isoélectronique au benzène à la différence que l’azote porte une charge. La charge positive diminue les densités électroniques des carbones du cycle notamment pour les carbones qui sont proches de l’azote. Les réactions avec les nucléophiles sont plus faciles avec le pyridinium qu’avec la pyridine, mais les réactions avec les électrophiles sont au contraire rendues plus difficiles. La délocalisation de la charge positive dans le cycle pyrimidique rend le cation plus stable et moins réactif qu'un cation non stabilisé.
Utilisation de la pyridine
La pyridine est souvent utilisée comme réactif ou bien comme catalyseur en synthèse organique dans des réactions de condensation, déshalogénation, halogénation ou d’acylation et aussi comme un précurseur pour la synthèse de produits intermédiaires utilisés dans la fabrications d’insecticides, d’herbicides, de médicaments, d’arômes alimentaires, de colorants, d’adhésifs, de peintures, d’explosifs et de désinfectants. La pyridine est alors utilisée comme précurseur à des réactions de substitution nucléophile et plus rarement des substitutions électrophiles ou bien des réaction d’alkylation sur l’azote. La pyridine est aussi utilisée pour dénaturer l’alcool, les antigels et les fongicides, et aussi comme adjuvant pour les teintures textiles.
La pyridine est couramment utilisée comme solvant basique polaire et permet de neutraliser la formation d’acide lors de certaines réactions. La pyridine est souvent utilisée comme solvant polaire aprotique basique ou simplement ajoutée au milieu réactionnel pour neutraliser les acides qui résultent de ces réactions. Cependant la haute température d’ébullition rend parfois la pyridine difficile à éliminer et d’autres solvants organiques avec une faible température d’ébullition sont utilisés.
La pyridine d5 deutérée où les hydrogènes de la pyridine ont été remplacés par des atomes de deutérium peut être utilisée comme solvant en spectroscopie RMN.
La pyridine et ses dérivés peuvent être utilisés pour activer certaines réactions d’acylation ou d’estérification.
- La 4-diméthylaminopyridine (DMAP) est utilisé pour activer les anhydrides lors de réactions d’acylation. L’intermédiaire est un sel 1-acylpyridium qui réagit avec une amine primaire ou secondaire pour former une amide.
- La 4-(1-pyrrolidinyl)-ppyridine (PPY) permet d’activer une réaction d’estérification entre un acide carboxylique et certains alcools en présence de DCC (dicyclocarbodiimide). Le PPY réagit avec l’intermédiaire formé par la réaction entre l’acide et le DCC, qui se comporte de la même manière qu’un anhydride d'acide.
La pyridine est très utilisée comme ligand en chimie de coordination (dans ce cadre, elle est abrégée « py ») car elle a une grande habilité à former des complexes avec de nombreux cations de métaux de transition. La pyridine est un ligand plutôt mou dans la théorie HSAB. Dans les complexes, une liaison azote-métal est formée. Ces complexes peuvent être utilisés pour des analyses sélectives.
Certains des complexes de la pyridine sont utilisés pour oxyder les alcools primaires ou secondaires.
- Le réactif de Collins ou de Sarette sont constitués par un équivalent d’acide chromique et deux équivalents de pyridine. Ils sont préparés par chauffage et diffèrent entre eux par leur forme cristalline.
- Le réactif de Conforth est constitué d’un équivalent de trioxyde de chrome et de deux équivalents de pyridine mélangée avec de l’eau
- Le dichromate de pyridinium PDC est constitué d’un équivalent de dichromate de deux équivalents de pyridine et d’acide chlorhydrique
- Le chlorochromate de pyridinium PCC est constitué d’un équivalent de trioxyde de chrome, d'un équivalent d’acide chlorhydrique et de pyridine.
La pyridine, avec de l’acide barbiturique est couramment utilisée pour la détection colorimétrique des cyanures en solution aqueuse. Elle réagit avec le chlorure de cyanure (formé par la réaction entre l’ion cyanure et la chloramine-T) pour former une espèce conjuguée avec deux molécules d’acide barbiturique, ensemble qui possède une teinte rouge. L’intensité de la coloration est directement proportionnelle à la concentration en cyanure.