Pyridine - Définition
La liste des auteurs de cet article est disponible ici.
Réactivité du noyau pyridinique
Les différents types de réactivités
La pyridine est l’hétérocycle qui a la réactivité la plus proche de celle du benzène. Cependant, la présence d’un atome d’azote dans le cycle déforme la distribution des électrons dans le cycle et la présence d’un doublet libre sur l’azote fournit un site pour la protonation et pour l’alkylation qui n’a aucune analogie vis-à-vis du benzène.
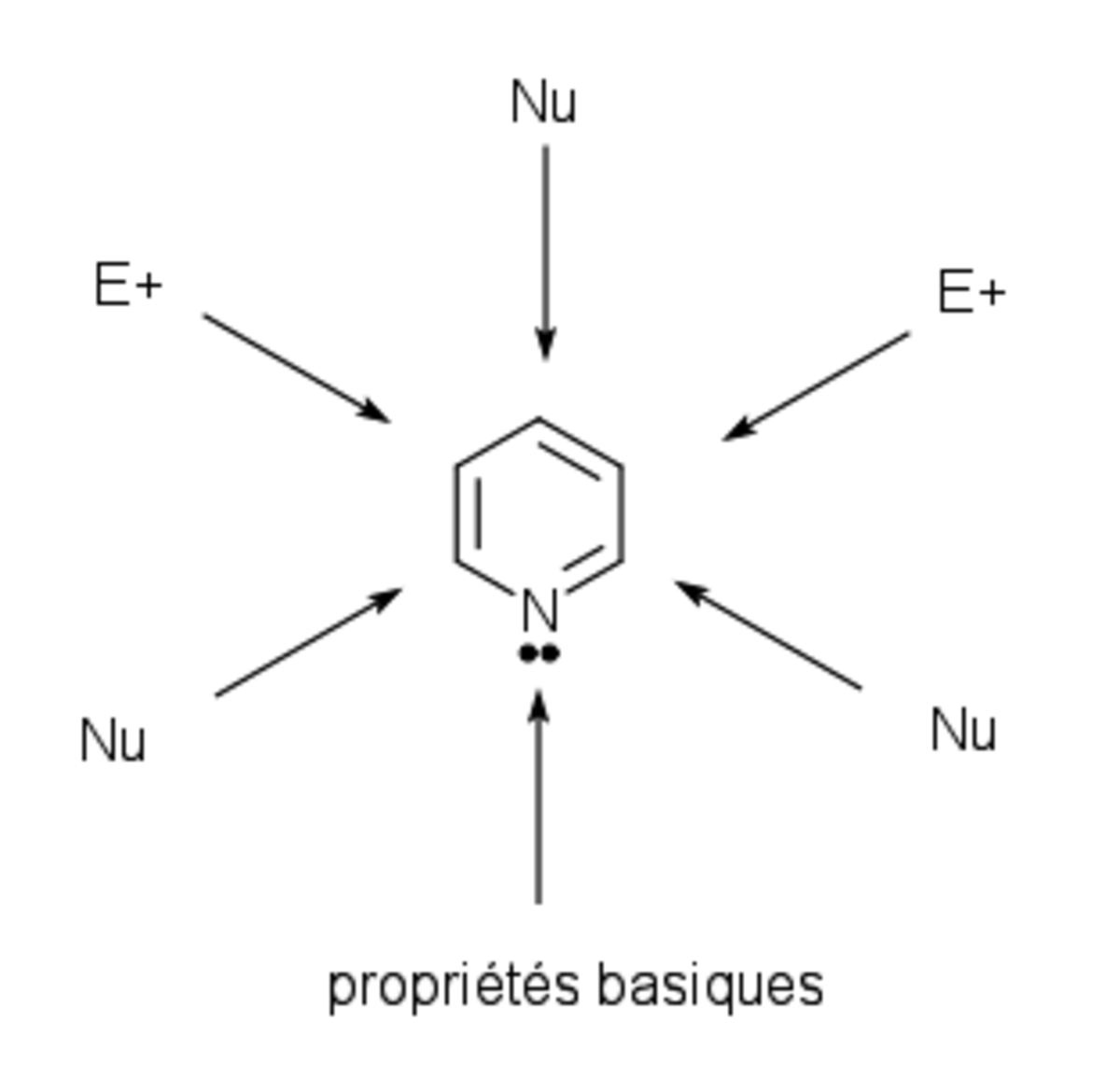
D’après la structure de la pyridine, trois types de réactivités sont attendues :
- la réactivité d’une amine tertiaire : protonation, alkylation, acylation, formation de N-oxyde et coordination avec les acides de Lewis
- la réactivité du benzène : réaction de substitution électrophile aromatique, résistance vis-à-vis des additions et des ouvertures du cycle
- la réactivité d’une imine conjuguée ou d’un carbonyle : attaque nucléophile en α ou γ
Le doublet libre de l’azote étant dans une orbitale sp², il n’est pas délocalisé et confère à la pyridine des propriétés basiques. Cela a pour effet de donner à la pyridine et à ses dérivés des propriétés chimiques assez différentes des dérivés du benzène. L’azote comporte une charge électronique partielle élevée aux dépens des carbones du cycle, qui vont ont une densité électronique plus faible. En conséquence, la pyridine va réagir plus difficilement que le benzène avec les électrophiles mais plus aisément avec les nucléophiles. Le caractère électroattracteur exercé par l’azote appauvrit considérablement le noyau aromatique.
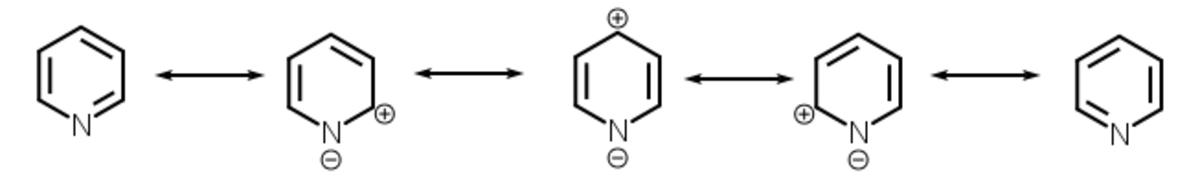
Les formes mésomères montrent que les positions 2,4 et 6 de la pyridine sont particulièrement appauvries en densité électronique, puisque l'on peut y faire apparaître des charges positives avec les formes de résonance. De plus, l'atome d'azote attirant les électrons du cycle, celui-ci est très désactivé. La pyridine possède du fait de cette attraction un moment dipolaire de 2,2 debye dont le pôle négatif est orienté vers l’azote.
En conséquence, les substitutions électrophiles aromatiques telles que la nitration ou l’halogénation se feront plutôt en position 3, mais souvent dans des conditions dures en l’absence de groupements donneurs sur le cycle (amines, éthers...). De même, les alkylations et acylations de Friedel et crafts sont inconnues sur la pyridine même. En contrepartie, les composés nucléophiles réagissent bien sur le cycle dans les positions appauvries 3, 4 ou 6, en addition ou en substitution.
La pyridine est une imine stable à cause de son aromaticité. En général, les imines sont des intermédiaires de réaction instables.
Régiosélectivité des substitutions sur la pyridine
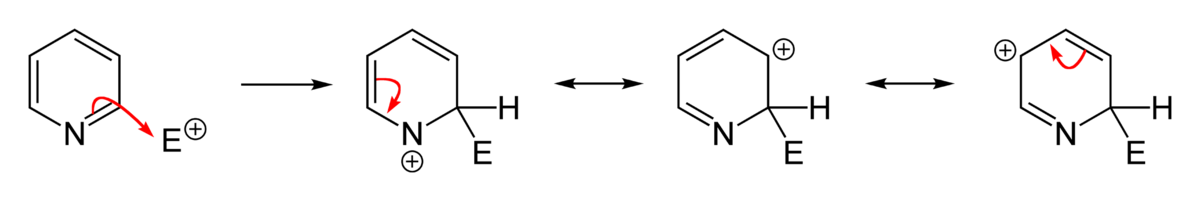
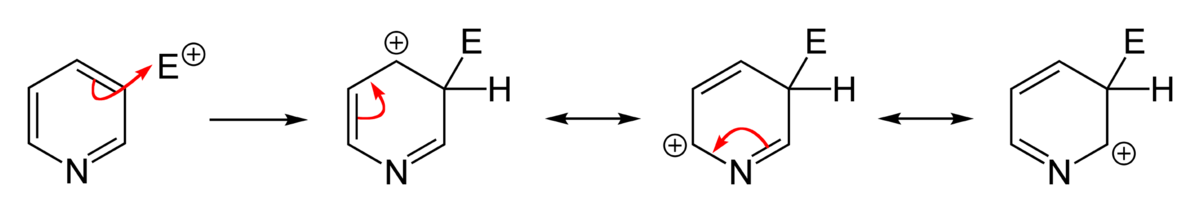
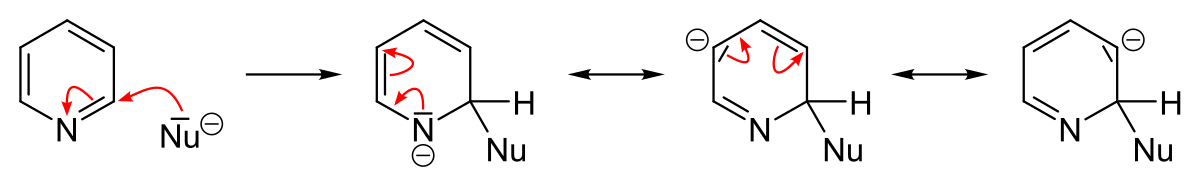
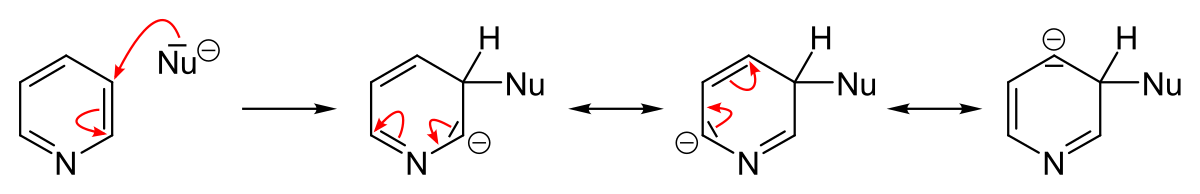
L’azote est un atome très électronégatif qui a une forte tendance à attirer les électrons. Un azote portant une charge négative est donc plus stable qu’un azote avec une charge positive. La position où va s’effectuer une substitution dépend de la stabilité de l’intermédiaire de la réaction. L’écriture des formes mésomères des intermédiaires d’une substitution montre qu’une substitution électrophile aromatique s’effectue préférentiellement en position 3 parce que la présence d’une charge positive sur l’azote est très défavorable tandis qu’une substitution nucléophile aura plutôt lieu en position 2, 4 et 6 parce que la présence d’une charge négative sur l’azote est très favorable.
L'écriture des formes mésomères permet de situer les charges partielles positives de la pyridine en position 2, 4 et 6.
Substitution électrophile aromatique
Les substitution électrophile aromatique sont difficiles à effectuer car la pyridine est moins réactive que le benzène et l’ion pyridinium est encore moins réactif que la pyridine pour les substitutions électrophiles. Lorsqu’une réaction de substitution électrophile a lieu, elle se déroule en position 3 et 5 de la pyridine, qui sont les positions les plus riches en électrons. Le produit cinétique est la pyridine complexée sur le doublet par l’électrophile. La réaction de substitution est difficile car elle doit avoir lieu sur le sel de pyridinium ou bien sur la petite quantité de pyridine non protonée qui est présente et non complexée avec l’électrophile. La présence de substituants donneurs d’électrons va augmenter la facilité de la réaction. Cependant, le passage par un N-oxyde de pyridine est préférable pour faire des réactions de substitutions électrophiles et permet d’obtenir de meilleurs rendements.
Les réactions classiques de substitutions électrophiles aromatiques telles que l’alkylation de Friedel-Crafts ou l’acylation de Friedel-Crafts n’ont tout simplement pas lieu. En effet, les acides de Lewis catalysant celles-ci coordonnent l’azote pour le rendre encore plus électroattracteur et les réaction de Friedel-Crafts ont lieu sur l’azote et non sur les carbones de la pyridine. Il est aussi possible d’alkyler ou d’acyler l’azote avec un halogénure d’acide ou d’alkyle sans acide de Lewis et sans autre nucléophile dans le milieu. La réaction de Mannich n’a pas lieu avec les pyridines sauf si elles sont substituées par des groupements électrodonneurs.
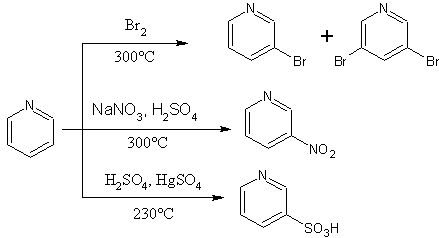
La nitration de la pyridine est difficile et nécessite des conditions fortes. À 370 °C, la pyridine réagit avec l’acide nitrique en présence d’acide sulfurique concentré pour conduire à la 2-nitropyridine (94%) et à la 3-nitropyridine (6%). La présence de groupements méthyles sur la pyridine favorise la nitration mais ces groupements sont partiellement oxydés en acide carboxylique. Ces groupements peuvent être éliminés par décarboxylation. Ainsi la luthidine et la collidine permettent d’obtenir la 3-nitropyridine après une nitration et une décarboxylation. De même, la présence d’un groupement hydroxyde ou amine sur la pyridine favorise la nitration. La 4-aminopyridine est nitrée sur la fonction amine puis se transforme en 4-amino-3-hydroxypyridine par réarrangement. La 2-hydroxypyridine est nitrée en position 4. Cependant un autre moyen d’obtenir la 4-nitropyridine est d’utiliser une pyridine N-oxyde avec un rendement de 85 % en présence d’acide sulfurique et d’acide nitrique.
A 320 °C, la sulfonation avec de l’oléum conduit à l’acide 3-sulfonique en petite quantité. À 360 °C le produit formé est l'acide 4-sulfonique. La réaction peut avoir lieu à plus basse température avec un catalyseur autour de 220 °C en présence de sulfate mercurique. La pyridine réagit avec les halogènes pour donner des composés cristallisés ou solubles dans le tétrachlorométhane.
Substitution aromatique nucléophile
Généralement, les réactifs nucléophiles effectuent une substitution : d’abord en position 2 et 5 puis en position 4 (bien que certains réactifs fassent l’inverse). L’attaque d’un nucléophile sur la pyridine est suivi de la perte d’un hydrure. La réaction n’est donc pas favorisée thermodynamiquement car l’hydrure est un très mauvais groupe partant et le départ de l’hydrure nécessite des conditions expérimentales vigoureuses. Par contre, si la réaction a lieu sur une pyridine halogénée, la réaction est plus facile car l’ion halogénure est un bon groupe partant. Les 2-halopyridines sont de très bon substrats pour les réactions de substitution nucléophile. Les 4-halopyridines sont des substrats un peu moins bons. Les 3-halopyridines sont très peu réactives.
La réaction de Chichibabin est une réaction de substitution nucléophile où un hydrure est remplacé par un groupement amidure. L’action de l’amidure de sodium, de baryum ou de potassium sur la pyridine conduit à la 2-aminopyridine. La réaction peut avoir lieu à sec mais en général, elle s’effectue dans les solvants aromatiques en ébullition. Les groupements hydroxyle, sulfate ou amide en position 2 ou 6 sur la pyridine peuvent aussi être substitués au cours de cette réaction. Dans cette réaction, les 3-alkylpyridines sont substituées en position 2 par un groupement amine tandis que les 2 et 4-alkylpyridine ont du mal à réagir car l’amidure a tendance à arracher un proton de la chaine alkyle pour former un carbanion qui réagit moins bien avec les nucléophiles.
La pyridine en présence de soude subit une attaque nucléophile de l'ion hydroxyde pour former la 2-hydroxy-1,2-dihydropyridine qui est oxydée en 2-pyridone avec un faible rendement. L'ion hydroxyde effectue une sustitution nucléophile identique à l'ion amidure mais dans des conditions plus vigoureuses.
La réaction des pyridines avec des alkyllithium ou des aryllithium conduit à des sels de lithium qui peuvent être parfois isolés mais qui en général perdent de l’hydrure de lithium pour être oxydés par le dioxygène et donner des pyridines substituées. La même réaction avec les organomagnésiens est possible mais plus difficile.
Oxydation et réduction
Le solvant le plus utilisé pour faire les oxydations en chimie organique est la pyridine. La pyridine est difficilement oxydable et résiste bien aux conditions expérimentales des réactions d’oxydation en milieu basique. Toutefois, elle est oxydée par le permanganate de potassium en présence de potasse (à 100 °C) en libérant du gaz carbonique comme le benzène. La pyridine est aussi oxydée par l’ozone. L’ozonolyse affecte les trois doubles liaisons. Si la pyridine est substituée par des groupements alkyles, ces groupements sont aussi oxydés.
La pyridine traitée par les acides peroxycarboxyliques (le plus souvent l’acide méta-chloroperbenzoïque) ou l’eau oxygénée dans l’acide acétique à 100 °C peut être oxydée en N-oxyde de pyridine. L’action du trichlorure de phosphore ou de la triphénylphosphine sur les N-oxyde de pyridine permet de retourner aux pyridines correspondantes. L’utilisation d’une hydrogénation catalytique douce peut être utilisée pour passer des pyridine N-oxyde aux pyridines simples. Les pyridines N-oxyde sont utilisées dans de nombreuses réactions à cause de leur meilleures réactivité vis-à-vis des substitutions nucléophiles par rapport aux pyridines.
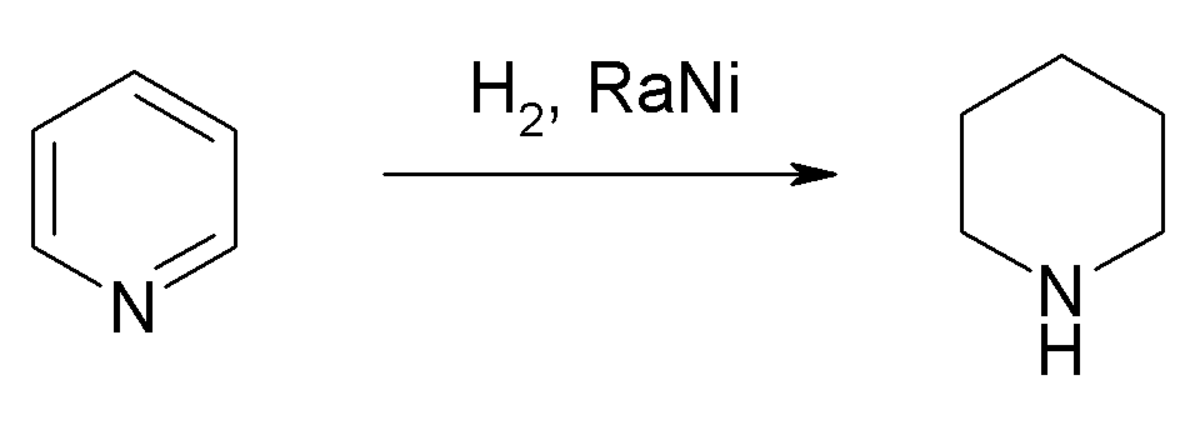
La pyridine est facilement réduite par le tétrahydruroaluminate de lithium LiAlH4 pour former la dihydropyridine puis la tétrahydropyridine et enfin la pipéridine. La pyridine est donc plus facilement réduite que le benzène. L’hydrogénation catalytique de la pyridine à 25 °C, en milieu faiblement acide avec du platine ou faiblement basique avec un amalgame de nickel fournit également la pipéridine. Le borohydrure de sodium n’a pas d’effet sur la pyridine. Cependant, ce réactif réduit les sels de pyridium et les pyridines avec un groupement électroattracteur. La réduction de Birch (sodium en solution dans l’ammoniac) permet de réduire la pyridine. Le radical anion intermédiaire peut se dimériser mais la présence d’une source de proton comme l’éthanol permet d’obtenir une 1,4 dihydropyridine.
Propriétés basiques et réaction sur l’azote
Le doublet de l’azote n’étant pas délocalisé, il confère à la pyridine des propriétés basiques. La pyridine est une base faible (l'ion pyridinium a un pKa de 5,23). Cette faible basicité est en contradiction avec le fait que le doublet semble bien disponible pour capter un proton. L’explication vient de l’hybridation de l’azote. Un composé hybridé sp3 a un effet inductif attracteur plus faible que l’azote hybridé sp2. Le doublet est donc plus lié à l’azote ce qui ne facilite pas sa protonation et diminue sa basicité. La basicité de l’azote permet les mêmes réactions que pour les amines tertiaires.
Les sels de pyridinium sont beaucoup plus réactifs envers les réactifs nucléophiles notamment en position ortho ou para. Ces additions sont parfois suivies d’une ouverture de cycle. Les sels d’alkylpyridine en présence d’hydroxyde d’argent donnent les hydroxydes correspondants et par chauffage en position β ils peuvent perdre une molécule d’eau. La réduction de sel de pyridinium N-acylé par le borohydrure de sodium conduit au 1,2 et 1,4 dihydropyridine.
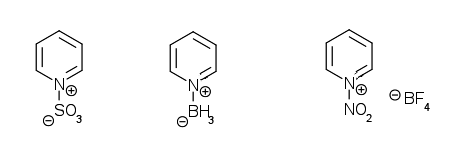
Les acides minéraux et organiques forts forment des sels stables avec la pyridine en protonant l’azote (chlorhydrate et sulfate de pyridium). Ces sels sont très solubles dans l’eau et très hygroscopiques. La présence de groupe à effet inductif donneur facilite la formation de sel en stabilisant la charge positive par effet inductif donneur. Les acides de Lewis sont inhibés par la pyridine car ils sont attaqués par le doublet de l’azote.
Les halogénures d’alkyle ou d’aryle activés forment avec la pyridine des sels de N-alkylpyridinium ou N-arylpyridinium. Cette réaction est utilisée pour faire des réactions de deshydrohalogénation qui conduisent aux alcènes. L’acrylonitrile et les acrylates réagissent lors d’une réaction de Mickael pour donner des sels de pyridium.
Les chlorures d’acyle réagissent facilement à 0 °C avec la pyridine pour donner des chlorures de 1-acylpyriridinium. Les chlorures d’acide arylsulfonique réagissent de la même manière. Les anhydrides d’acide forment aussi des complexes..
Les substituants présents sur la pyridine influencent les propriétés basiques du noyau. Un groupement avec un effet mésomère donneur en position 4 augmente la basicité en stabilisant le cation et en délocalisant la charge positive. La basicité diminue lorsque des groupements avec un effet mésomère attracteur sont sur le cycle.
|