Chloral - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chloral | |
|---|---|
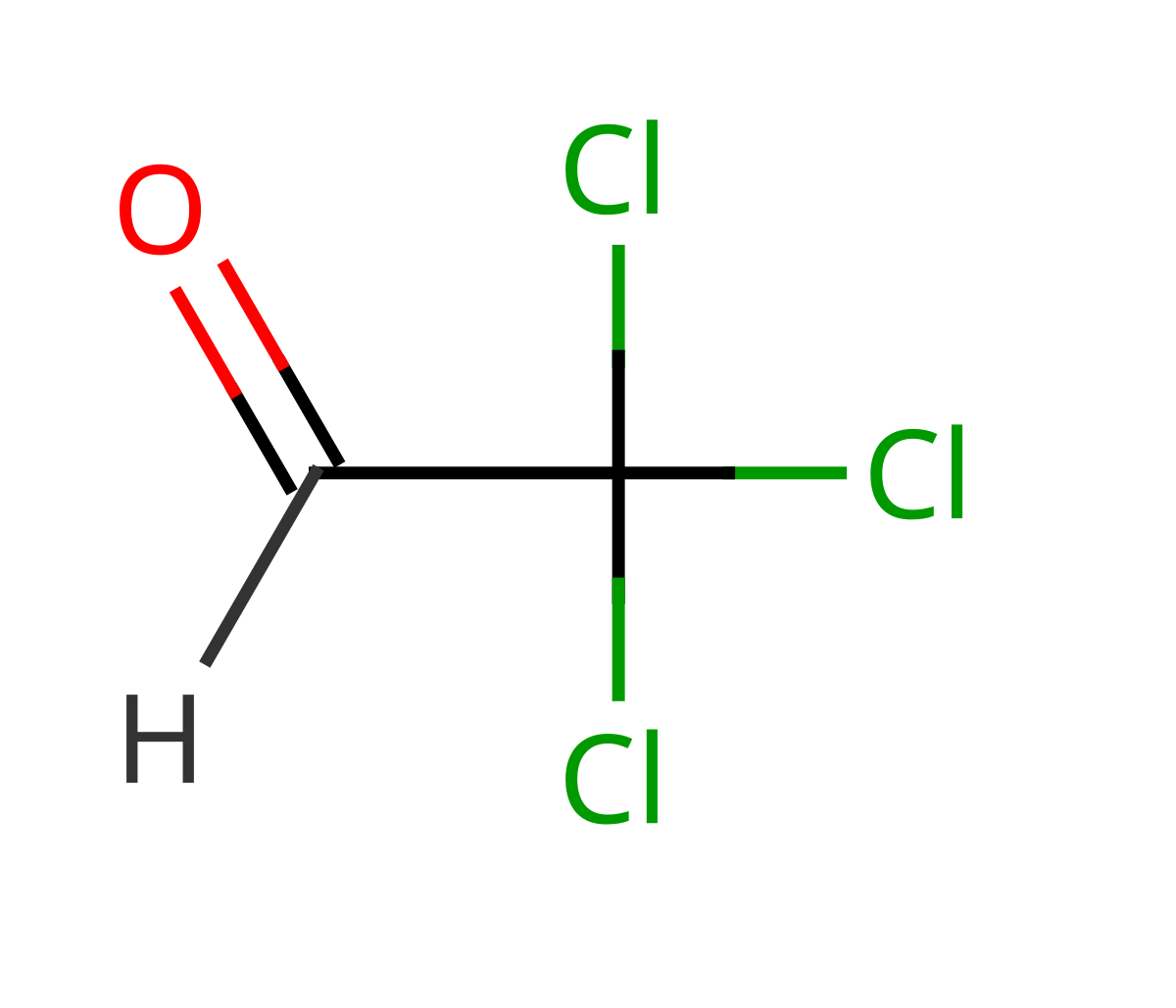
| |
| Général | |
| Nom IUPAC | |
| No CAS | |
| No EINECS | |
| Propriétés chimiques | |
| Formule brute | C2HCl3O CCl3CHO |
| Masse molaire | 147,388 ± 0,008 g·mol-1 |
| Propriétés physiques | |
| T° fusion | -57,5 °C |
| T° ébullition | 97,8 °C |
| Masse volumique | 1 512 kg·m-3 |
| Pression de vapeur saturante | 5 200 Pa (20 °C) |
| Précautions | |
| | |
| Produit non classifié | |
| | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |
| | |
Le chloral est un composé chimique organique découvert en 1832 par Justus von Liebig (1803-1873).
Propriétés chimiques
- Noms : Chloral, trichloracétaldéhyde ou trichloroéthanal.
- Formule semi-développée : voir figure 1.
- Masse molaire = 147,39 g/mol
Ne pas confondre chloral et chloroforme CHCl3.
Propriétés physiques
C'est un liquide d'apparence huileuse et lourde.
- Masse volumique = 1,91 g/cm3 (1,541 g/cm3 à 0 °C)
- Température de fusion = -57 °C
- Température d'ébullition = 97 °C
Le chloral est soluble dans l'éthanol et l'éthoxyéthane (éther éthylique).
Préparation
Le chloral est obtenu par la réaction du dichlore sur l'éthanol selon la réaction chimique suivante :

Le nom chloral tire son origine des premières syllabes des mots chlore et aldéhyde, le chloral appartenant au groupe fonctionnel des aldéhydes.
Risques pour la santé
- Son odeur est piquante et a un effet irritant pour les yeux, pouvant provoquer une conjonctivite.
- Neurotoxique pour les centres bulbo-protubéranciels dans le cerveau.
- Seulement 10 g de chloral peuvent tuer un être humain.
- Le chloral attaque le cerveau en provoquant l'hébétude, la confusion, puis des convulsions musculaires ressemblant aux chorées.
- Le chloral provoque des léthargies ou des insomnies.
- Le chloral provoque aussi des maux de tête terribles.
- Il est nocif pour les organes uro-génitaux et la peau.
- Le chloral a des effets mutagènes et cancérigènes chez l'animal.
- Gastrite irritative pouvant entraîner des vomissements
Dérivé
L'hydrate de chloral est utilisé en thérapeutique depuis de nombreuses années comme sédatif, hypnotique ou analgésique. En pharmacie, la posologie est de 50 à 75 mg·kg-1 de masse corporelle en une seule dose. Pour le fabriquer, il suffit de d'ajouter de l'eau au chloral et il réagira pour donner de l'hydrate de chloral. Réaction:
- Cl3C-CH=O + H20 réagira pour donner du Cl3C2H(OH)2
Dérivé chimique : hydrate de chloral
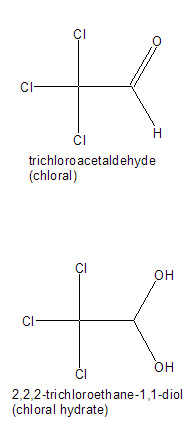
- L'hydrate de chloral est connu sous la dénomination 2,2,2-trichloroéthan-1,1-diol, trichloracétaldéhyde monohydrate. Il s'agit d'un mélange des deux molécules (figure 2).
Propriétés pharmacologiques de l'hydrate de chloral
- Anti-mitotique - Anticancéreux
- Psycholeptique
- Sédatif
- Hypnogène
- Analgésique
- Anticonvulsif


















































