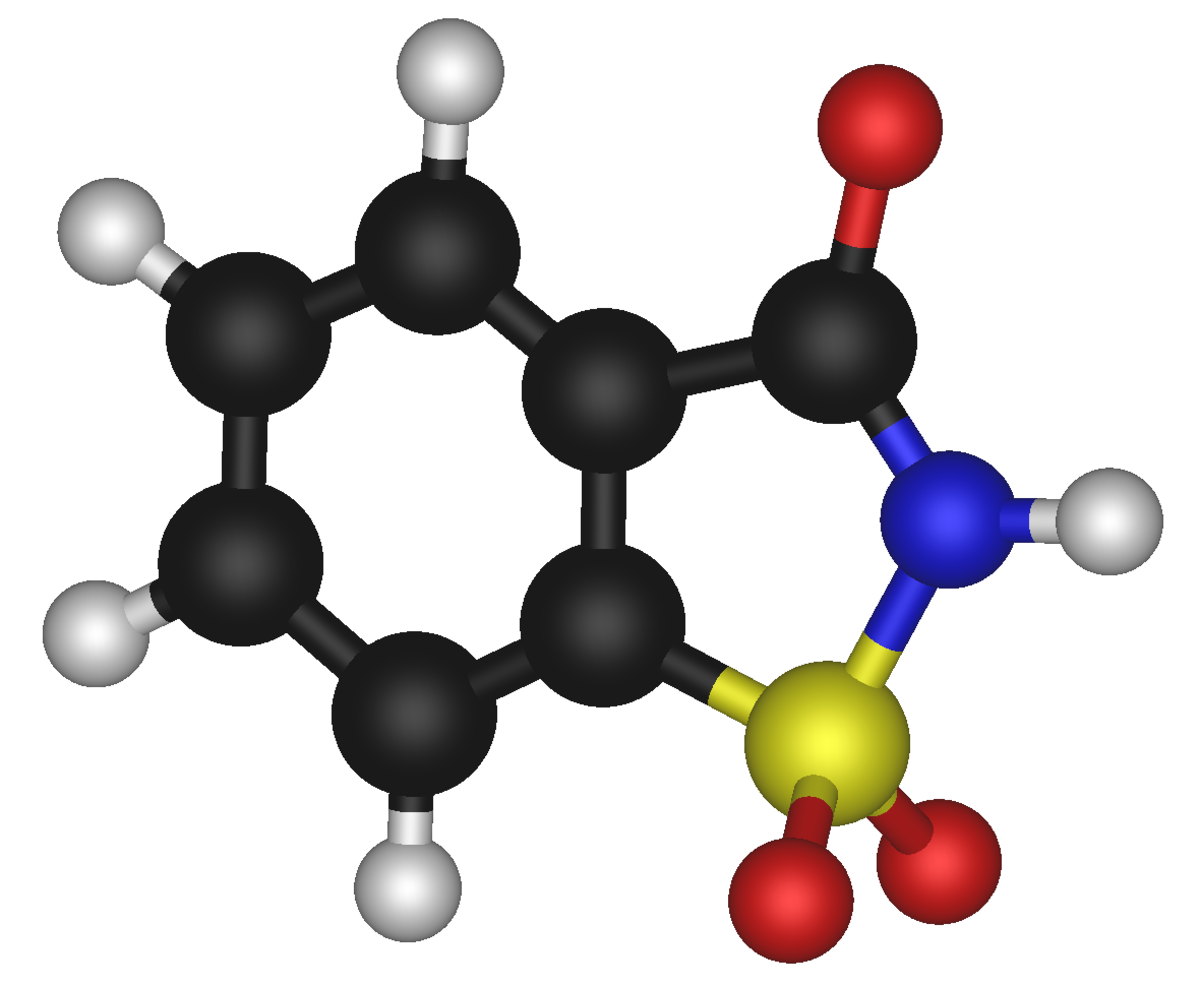
Saccharine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Saccharine | |||
|---|---|---|---|
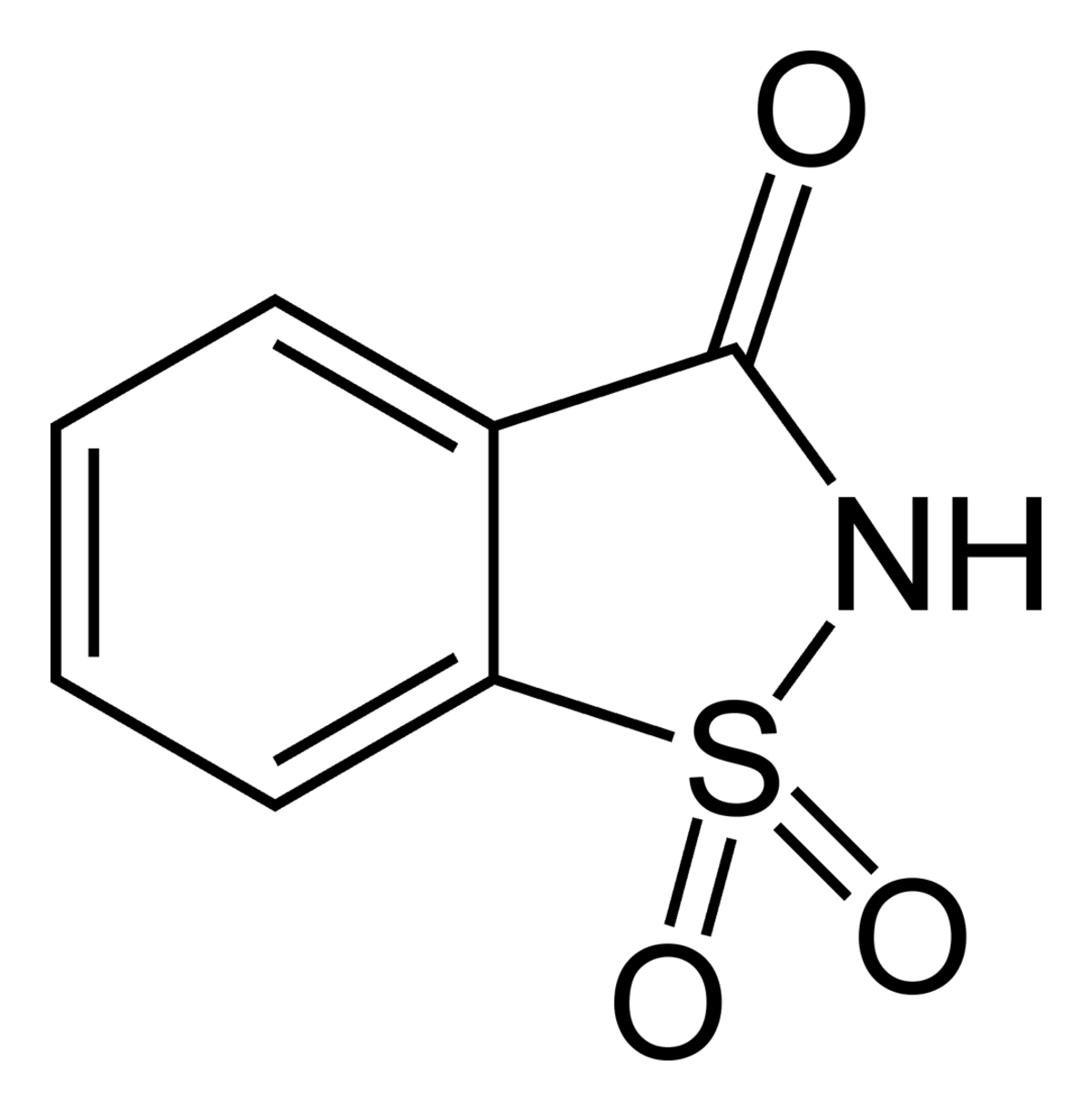
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Sulfinide benzoïque | ||
| No CAS | (acide) (Na) | ||
| No EINECS | (Na) | ||
| PubChem | |||
| No E | E954(i), E954(ii), E954(iii), E954(iv) | ||
| FEMA | |||
| SMILES | |||
| InChI | |||
| Apparence | Poudre blanche | ||
| Propriétés chimiques | |||
| Formule brute | C7H5NO3S | ||
| Masse molaire | 183,185 ± 0,012 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 228 °C (décomposition) | ||
| Solubilité | 4 000 mg·l-1 (eau, 25 °C) | ||
| Masse volumique | 0,828 | ||
| Cristallographie | |||
| Classe cristalline ou groupe d’espace | P21/c | ||
| Paramètres de maille | a = 9,563 Å b = 6,913 Å | ||
| Volume | 758,82 Å3 | ||
| Densité théorique | 1,603 | ||
| Précautions | |||
| | |||
| Phrases S : 24/25, | |||
| | |||
| |||
| Écotoxicologie | |||
| DL | 17 000 mg·kg-1 (souris, oral) | ||
| LogP | 0,91 | ||
| | |||
La saccharine (ou saccarine) est le plus ancien des édulcorants artificiels ; elle est référencée sous le numéro E954.
La saccharine a un pouvoir sucrant 300 à 400 fois plus élevé que le sucre, mais a un arrière goût métallique ou amer déplaisant, spécialement à hautes concentrations. Elle est ainsi souvent mélangée avec d'autres édulcorants pour compenser cette faiblesse : une proportion de 10 pour 1 entre le cyclamate et la saccharine est utilisée dans les pays où ces deux substances sont autorisées.
La saccharine n'apporte aucune calorie et est éliminée du corps par le système digestif sans passer dans le sang.
Elle est stable face à la chaleur (contrairement à l'aspartame), même en milieu acide, ne réagit pas chimiquement avec les aliments et se conserve bien. La saccharine est souvent mélangée avec l'aspartame pour sucrer les boissons pour régimes, de sorte que le sirop de base reste sucré au-delà de la durée de vie relativement courte de l'aspartame.
Synthèse
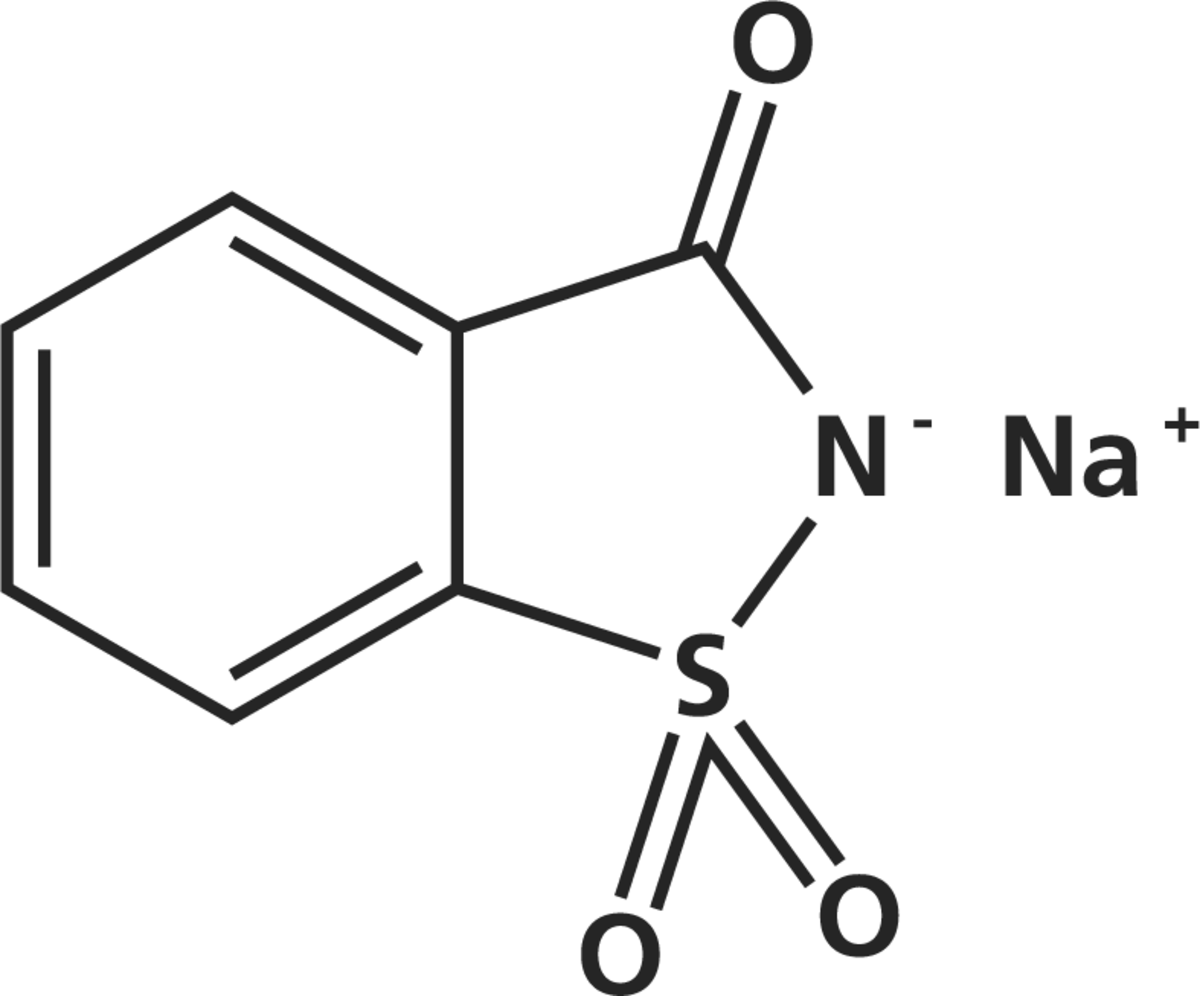
La saccharine peut être produite de plusieurs manières. La voie de synthèse originale de Remsen et Fahlberg débute par du toluène, mais le rendement par cette voie est faible. En 1950, une synthèse améliorée a été développée par Maumee Chemical Company à Toledo (Ohio). Dans cette voie, l’acide anthranilique réagit successivement avec de l’acide nitreux, du dioxyde de soufre, du chlore et ensuite de l’ammoniaque pour obtenir de la saccharine. Une autre voie commence avec l’o-chlorotoluène (Bungard, 1967).
Sous sa forme acide (E954(i)), la saccharine n'est pas particulièrement hydrosoluble. La forme utilisée comme édulcorant est habituellement le sel de sodium (E954(iv)). Le sel de calcium est également utilisé (E954(ii)), spécialement par les personnes qui limitent leur consommation de sodium. Les deux sels sont très hydrosolubles : 670 g par litre d'eau à température ambiante. Elle existe aussi sous forme de sel de potassium (E954(iii)).