Thalidomide - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Thalidomide | ||
|---|---|---|
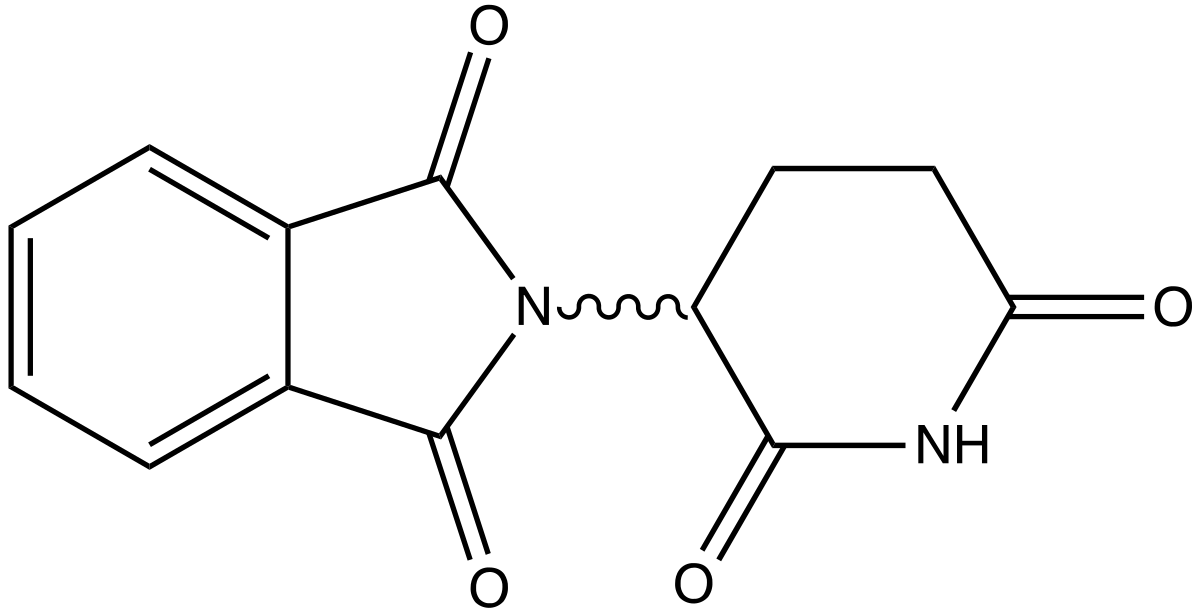
| ||
| Général | ||
| Nom IUPAC | ||
| No CAS | ||
| No EINECS | ||
| Code ATC | L04 | |
| DrugBank | ||
| PubChem | ||
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule brute | C13H10N2O4 | |
| Masse molaire | 258,2295 ± 0,0127 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 270 °C | |
| Solubilité | 545 mg·l-1 (25 °C) | |
| Précautions | ||
| | ||
| ||
| Phrases R : 21, 25, 46, 61, 62, | ||
| Phrases S : 22, 26, 36/37/39, 45, | ||
| | ||
La thalidomide est un médicament utilisé durant les années 1950 et 1960 comme hypnogène (effet hypnotique) chez l'enfant, comme sédatif et antiémétique (contre les nausées matinales) chez les femmes enceintes. Synthétisée en Allemagne de l'Ouest en 1953, il est mis sur le marché par la firme Chemie Grünenthal (Stolberg-lès-Aachen) en 1957, principalement en Allemagne et Grande-Bretagne.
Provoquant de graves malformations congénitales des membres, il fut retiré du marché mondial en 1961 suite au scandale de sécurité sanitaire qu'il souleva, mais est actuellement réutilisé pour ses propriétés immunomodulatrices et antitumorales.
| ||||
|---|---|---|---|---|
Noms commerciaux :
| ||||
| Autres informations : Sous classe : | ||||
La tragédie de la thalidomide
Les tests de toxicité chronique sur l'animal ainsi que les essais cliniques chez l'homme, effectués en 1956, n'avaient démontré aucune toxicité particulière. Les effets tératogènes de la thalidomide furent en effet testés sur des rates gravides. Or les rongeurs ne sont pas sensibles à ce médicament, car les métabolites synthétisés sont différents entre les rongeurs et les autres mammifères (des tests plus récents ont mis en évidence l'action tératogène chez la lapine). Le médicament fut donc mis sur le marché le 1er octobre 1957 dans environ 50 pays, mais pas aux États-Unis, sous au moins 40 noms différents (Softénon, Talimol, Kevadon, Nibrol, Sedimide, Quietoplex, Contergan, Neurosedyn, etc.).
À Hambourg existait un centre d'épidémiologie qui surveillait le taux d'anomalies dans la population de la ville. Dès 1960, il montra un effet tératogène sur le développement fœtal par une augmentation de la fréquence des anomalies des membres.
Ces anomalies "thalidomide" touchaient les membres de manière plus ou moins importante. Cela allait de l'amélie (absence de membre), l'ectromélie (absence de l'extrémité du membre), la phocomélie (réduction du segment intermédiaire) aux anomalies mineures de la main comme la syndactylie. Elles étaient induites par la capacité du médicament à inhiber l'angiogénèse - en interférant avec le développement des vaisseaux sanguins du fœtus, surtout en cas de prise au cours des 25 à 50 premiers jours de la grossesse, la molécule ayant un effet d'intercalation dans les molécules d'ADN. Découvrant ces données, un obstétricien écossais prouva que sur dix mères ayant donné naissance à un enfant ayant ces malformations, neuf avaient pris de la thalidomide.
En décembre 1961, alors que la FDA lui réclamait des documents supplémentaires, la "Chemie Grünenthal" ordonna son retrait et celui de tous les autres médicaments contenant de la thalidomide au niveau mondial. Après ce retrait, un débat éthique s'est ouvert, posant le problème moral de l'interruption de grossesse chez les femmes l'ayant déjà absorbé. En effet, environ 15 000 fœtus ont été affectés par la thalidomide, parmi lesquels 12 000 dans 46 pays sont nés avec des défauts congénitaux (3 000 victimes pour l'Allemagne elle seule, très peu en France où le médicament n'était pas commercialisé). Parmi eux, seuls 8 000 ont vécu au delà d'un an. En ce début du XXIe siècle, la plupart des personnes affectées sont encore en vie mais beaucoup gardent des handicaps occasionnés par le médicament. Plus tard, l'on découvrit que les handicaps et déformations de bien des survivants à la thalidomide se transmettaient à leurs propres enfants par le truchement de l'ADN modifié. Mais à l'heure actuelle, il y a une controverse à ce sujet.
Malgré ce scandale, la thalidomide est apparue dès cette époque comme ayant un potentiel antitumoral. Elle a, par la suite, été utilisée dans des maladies graves, en l'absence d'autres options thérapeutiques, notamment contre le myélome ou la maladie de Crohn. En avril 2008, une autorisation de mise sur le marché européenne de la molécule a été accordée : elle est utilisée comme médicament orphelin dans le traitement de la lèpre et du lupus érythémateux disséminé (LED) mais sa seule indication retenue en France est dans le traitement des myélomes multiples chez le patient non éligible à l'autogreffe. Il est alors associé à Melphalan et Prednisone et permet l'allongement de la durée de vie des patients atteints de ce type de cancer hématologique grave.
La thalidomide serait intéressante dans la cachexie du patient cancéreux du fait de son action anticytokine et anti TNF alpha, ce dernier étant anorexigène. Elle a des résultats prometteurs avec la maladie de Rendu-Osler, du fait de ses propriétés immunomodulatrices.
En France, sa prescription est limitée à un mois chez les femmes pouvant procréer.
C'est le scandale de ce médicament qui a renforcé la pharmacovigilance coordonnée au niveau mondial.


















































