Thymine DNA glycosylase - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
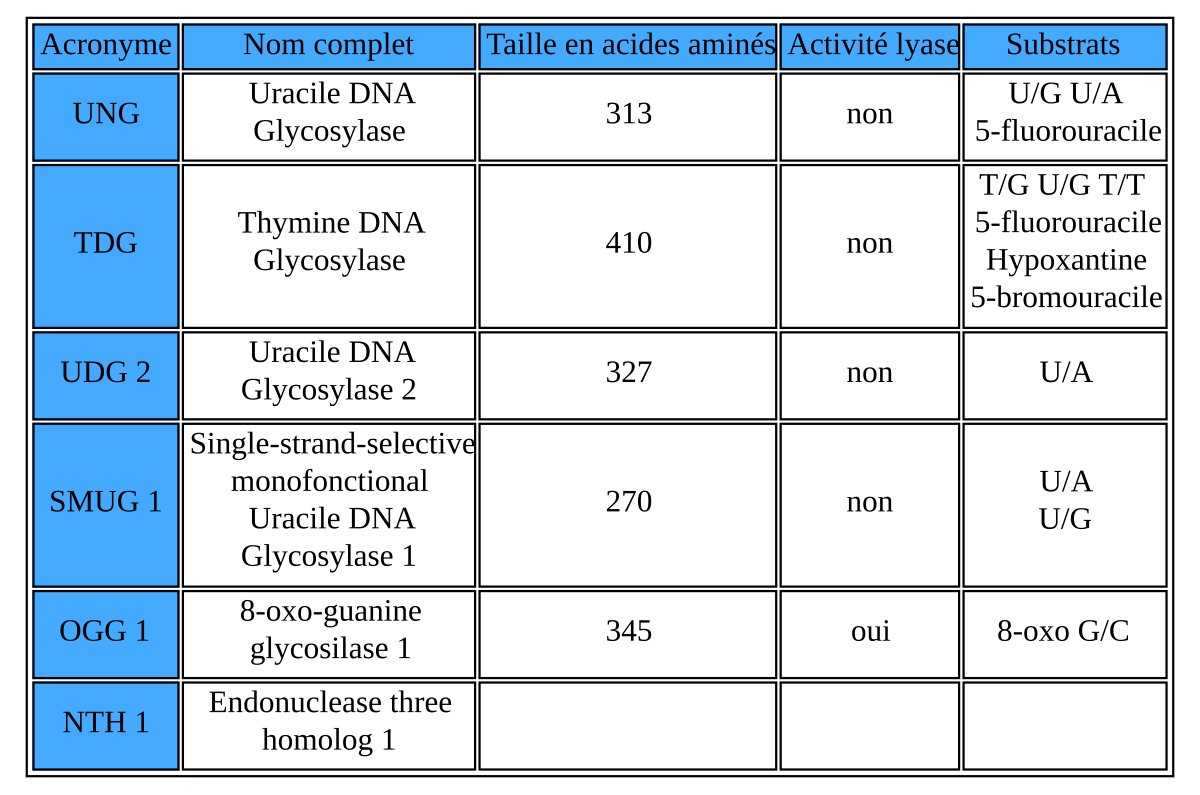
La thymine DNA glycosylase ou G/T mismatch-specific thymine DNA glycosylse (TDG) est une enzyme. Chez l'homme c'est une protéine monomérique de 410 acides aminés codés par 1233 paires de bases sur le chromosome 12 locus 24.1.. C’est une protéine qui agit à plusieurs niveaux de régulation mais qui n’a qu’une fonction catalytique : la réparation de l’ADN.
Utilisation
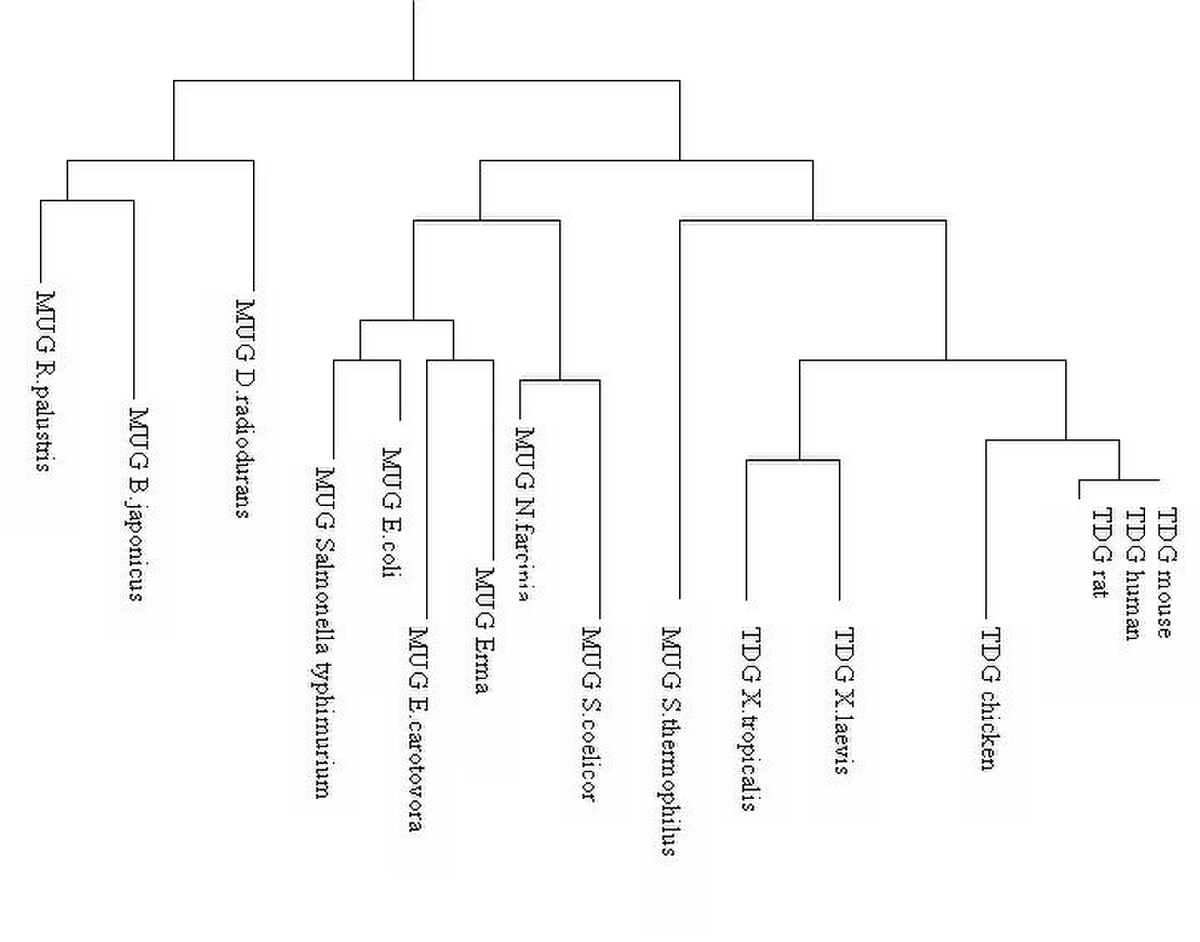
Depuis les découvertes des glycosylases d'ADN dans les années 1975, les variations de la thymine DNA glycosylase est utilisée pour déterminer la parenté dans l'arbre phylogénétique des vertébrés car une certaine homologie est gardée à travers le temps et les différentes espèces. Ceci est caractérisé par la conservation du site catalytique de la TDG. L'uracile DNA glycosylase (MUG) joue le même rôle dans les autres embranchements. Il semblerait par exemple que la MUG Escherichia coli possède 37% d’homologie avec la TDG humaine.
Les principes de réparation de l'ADN
Au cours de sa vie, une cellule, peu importe sa provenance, est confrontée à des événements susceptibles de créer des erreurs de réplication ou encore des mutations dans son ADN. Ces erreurs sont possiblement créées par la désamination, l’oxydation ou l’alkylation des bases azotées. De plus, les rayons X ou les UV ont la capacité d’endommager l’ADN. De nombreuses méthodes sont utilisées par la cellule pour réparer son ADN et celle utilisée, ainsi que les enzymes impliqués dépendent entre autres de l’importance de la mutation. En effet, ces dernières ne créent pas un même degré de distorsion de la double hélice lorsqu’elles se produisent. Un simple mésappariement d’une base azotée ne produit pas une distorsion de l’ADN suffisante pour être reconnue par tous les enzymes de réparation. Par contre, la thymine DNA glycosylase est en mesure de détecter cette erreur et de la réparer.
On dit de la TDG qu’elle est une glycosylase monofonctionnelle c’est-à-dire qu’elle hydrolyse le lien N-glycosydique entre le squelette de désoxyribose phosphate et la base endommagée afin de créer un site abasique ou « site AP ». Elle est incapable de couper le squelette lui-même, d’autres enzymes auront cette tâche.
Afin de contrer certains mésappariements de l’ADN, la TDG utilise la voie du « Base excision repair » (BER), contrairement à d’autres enzymes de réparation qui peuvent utiliser la voie du « Nucleotid excision repair » (NER). La TDG est en mesure d’exciser une base azotée endommagée en suivant le principe du « short patch repair » une des voies du BER.
| Premièrement, lorsqu’il y a une base azotée endommagée dans un brin double d’ADN, la Thymine DNA glycosylase la reconnaît et signale l’emplacement de la mutation. La TDG hydrolyse le lien N-glycosidique par lequel la base est attachée au squelette de sucre et la mutation est enlevée, le site AP est créé. Lorsque la TDG dégage la base endommagée, une forte affinité s’installe entre l’enzyme et la guanine restante en face du site AP. L’endonucléase APE-1, en s’approchant de la TDG, permettra de diminuer cette affinité afin de déloger la TDG du site AP. L’APE-1 pourra ensuite effectuer le clivage du nucléotide abasique. La Pol β viendra ensuite polymériser le nouveau nucléotide et la ligase 3 terminera la réparation. |