Américium - Définition
La liste des auteurs de cet article est disponible ici.
Applications
La forte radiotoxicité de l’américium le rend peu compatible avec une utilisation en quantité importante, et il est uniquement utilisé pour des applications liées à son rayonnement ionisant. Il est conservé dans des sources scellées et conditionnées dans une double enveloppe cylindrique en acier inoxydable.
Les applications concernent surtout l’isotope 241Am, dont l’élaboration sous forme pure est la plus aisée.
L’américium a ainsi trouvé une application domestique :
- la plupart des modèles de détecteurs de fumée contiennent une petite quantité de 241Am, sous forme d’oxyde AmO2 dont les émissions alpha alimentent une chambre d’ionisation.
- Ce même isotope est également utilisé comme source de rayons gamma dans le domaine de la cristallographie.
- Enfin, mélangé au béryllium ou au bore, il constitue une source de neutrons indirects avec des applications dans la radiographie.
Dans la source 241Am-Be, les neutrons sont ainsi produits selon deux réactions successives :
-
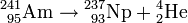
-
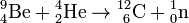
L’américium 242 a aussi été utilisé dans la radiographie, mais son coût de production est très élevé.
Propriétés chimiques
L’américium est un métal dont l’état solide présente trois formes cristallographiques, notées α (jusqu’à 1042 K ; 729 °C), β (entre 1042 et 1350 K ; 729 °C et 1 077 °C), et γ (entre 1350 et 1449 K ; 1 077 °C et 1 176 °C). Il devient liquide à 1449 K (1 176 °C) et gazeux à 2284 K (2 011 °C).
Il existe de nombreux composés chimiques de l’américium :
- oxyde : AmO et AmO,
- halogénure : AmF, AmF, AmCl, AmBr et AmI,
- sulfure : AmS,
- hydrure : AmH,
- carbure : AmC.
En milieu aqueux, l’américium est essentiellement à l’état d’oxydation +3. Le cation Am3+ est susceptible de se complexer avec différents ligands (CO32-, OH-, NO2-, NO3- et SO4-2) :
- hydroxyde : Am(OH)2+, Am(OH)2+, Am(OH)3,
- carbonate : AmCO3+, Am(CO3)2-, Am(CO3)33-,
- sulfate : AmSO+, Am(SO)-,
- nitrate : AmNO2+.
Il existe également en milieu aqueux des complexes de l’ion américyle AmO+ :
- AmO2CO3-, AmO2(CO3)23- et AmO2(CO3)35-.
Aspects sanitaires et environnementaux
L’américium 241 mesuré dans l’environnement provient soit d’un rejet direct, soit indirectement de la décroissance de l’isotope 241Pu.
On distingue 3 causes majeures de rejets:
- Les essais nucléaires atmosphériques (estimées à 80 % du total).
- Les rejets des installations nucléaires lors du traitement du combustible.
- Et les rejets dus à des accidents (principalement l’explosion de la centrale de Tchernobyl en 1986).
Après dissémination dans l’environnement, l’américium peut être incorporé dans tous les constituants de la chaine alimentaire et présenter diverses formes chimiques plus ou moins solubles. L’américium est un composé moyennement transférable, qui se dépose principalement dans le squelette, le foie et les gonades, quelle que soit l’espèce considérée. À ce titre, il a un comportement proche de ceux des autres éléments transuraniens. Il se distingue toutefois du plutonium par un temps de rétention dans les organes moins important et une toxicité moins prononcée. La CIPR retient une période biologique de 20 ans.