Boléite - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| | |||
|---|---|---|---|
| | |||
| | |||
| Catégorie | Minéral | ||
| Formule brute | KPb26Ag9Cu24Cl62(OH)48 | ||
| Numéro CAS | |||
| | |||
| Masse formulaire | 10 936,64 g/mol | ||
| Couleur | bleu indigo, bleu clair | ||
| Classe cristalline et groupe d'espace | Hexakisoctaédrique ; Pm3m | ||
| Système cristallin | cubique | ||
| Clivage | parfait à {001}, bon à {101} | ||
| Échelle de Mohs | 3 - 3,5 | ||
| Éclat | vitreux à nacré | ||
| | |||
| Indice de réfraction | n=2,05 | ||
| Biréfringence | Δ=0,000 (isotrope) | ||
| Dispersion | 2vz ~ nulle | ||
| Polychroïsme | nul | ||
| Trait | bleu-vert clair | ||
| Transparence | translucide | ||
| | |||
| Densité | 4,95 | ||
| Fusibilité | fond et donne une boulette magnétique | ||
| Solubilité | difficilement soluble dans HCl | ||
| | |||
| Radioactivité | à peine détectable | ||
| | |||
La boléite est une espèce minérale composée d'oxy-halogénure de cuivre de formule KPb26Ag9Cu24Cl62(OH)48.
Inventeur et étymologie
La boléite a été décrite conjointement par François Ernest Mallard et Edouard Cumenge en 1891. Le nom est inspiré de la localité-type, Boleo au Mexique.
Topotype
Mine Amelie, Boleo, Santa Rosalia, Basse-Californie, Mexique
Cristallographie
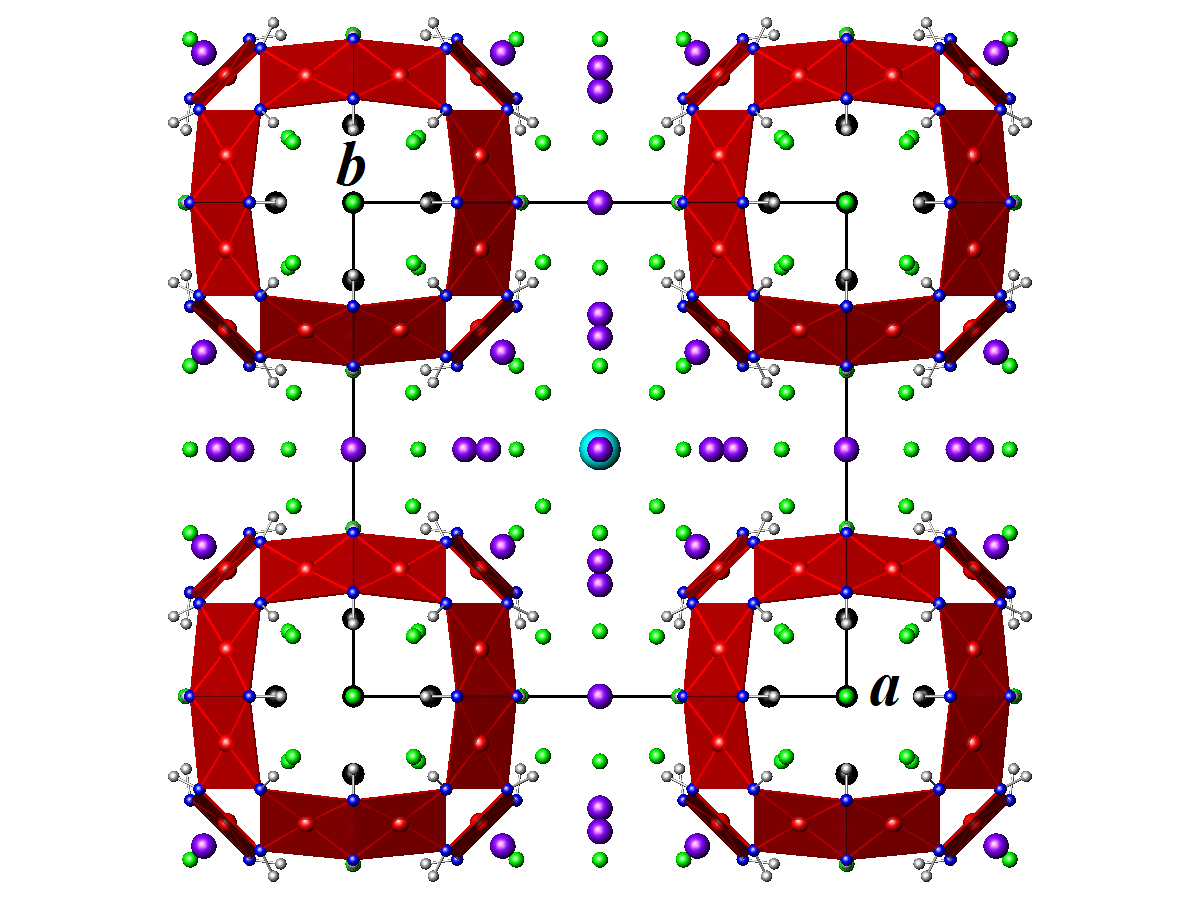
La boléite cristallise dans le groupe d'espace cubique Pm3m (Z = 1).
- Paramètres de la maille conventionnelle : a = 15,288 Å ; V = 3 573 Å3
- Densité calculée = 5,08 g/cm3
Les atomes de potassium sont en coordination (12) cuboctaédrique de chlore et forment des groupes KCl12.
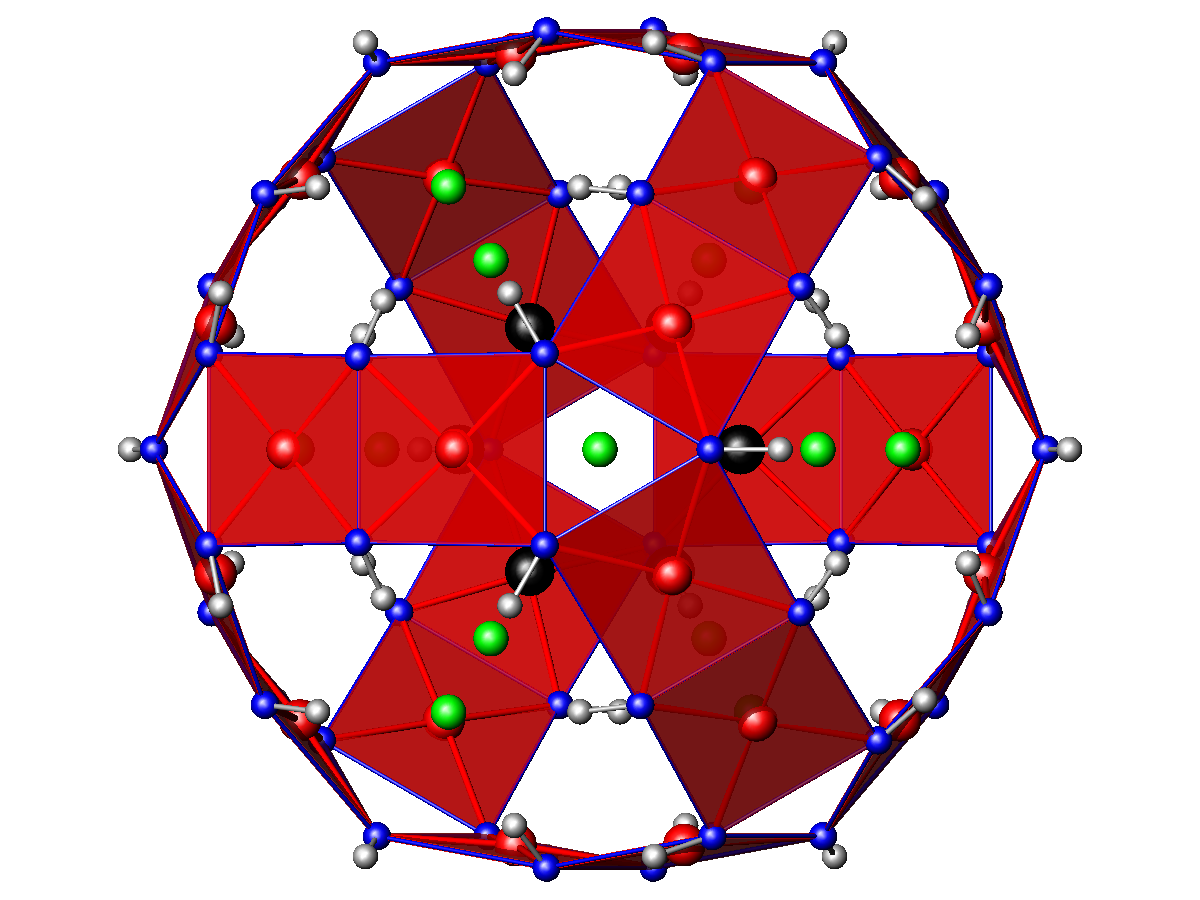
Les atomes de plomb sont répartis sur trois sites non-équivalents d'environnements différents :
- coordination (8) tétragonale antiprismatique déformée de chlore : groupes PbCl8 ;
- coordination (6+3) de chlore et de groupes hydroxyles : groupes PbCl6(OH)3 ;
- coordination (6+2) trigonale prismatique déformée de chlore avec un groupe hydroxyle au-dessus de deux des faces : groupes PbCl6(OH)2.
Les atomes d'argent sont répartis sur deux sites non-équivalents d'environnements différents :
- coordination (5) tétragonale pyramidale déformée de chlore : groupes AgCl5 ;
- coordination (6) octaédrique aplatie de chlore : groupes AgCl6.
Les groupes AgCl5 sont reliés par les arêtes de leur base quadratique et forment des groupes Ag6Cl14, dans lesquels les atomes d'argent sont arrangés aux sommets d'un octaèdre régulier ; ces groupes sont reliés entre eux dans les trois directions de l'espace {100} par les sommets des octaèdres AgCl6.
Les atomes de cuivre sont en coordination (4+2) octaédrique déformée de groupes hydroxyles et de chlore. La distribution des longueurs de liaison dans les octaèdres CuCl2(OH)4, quatre liaisons Cu-O courtes (1,96 Å et 1,97 Å) et deux liaisons Cu-Cl plus longues (2,82 Å et 2,92 Å), est typique de l'effet Jahn-Teller rencontré dans les composés de Cu(II) et permet une description alternative de la structure en termes de groupes plans carrés Cu(OH)4. Dans cette description, les groupes Cu(OH)4 sont reliés par leurs arêtes et forment des dimères Cu2(OH)6 ; ces dimères sont reliés par leurs sommets et forment des cages Cu24(OH)48 ouvertes dans les directions {100}, contenant les groupes Ag6Cl14.
| Structure de la boléite projetée dans le plan (a, b). Violet : Pb, noir : Ag, rouge : Cu, cyan : K, vert : Cl, bleu : O, gris : H. Le parallélépipède noir représente la maille conventionnelle. |