Bromure d'hydrogène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
-
- Cet article concerne le gaz bromure d'hydrogène. Pour des informations concernant le bromure d'hydrogène en solution, voir l'article acide bromhydrique.
| Bromure d'hydrogène | |||
|---|---|---|---|

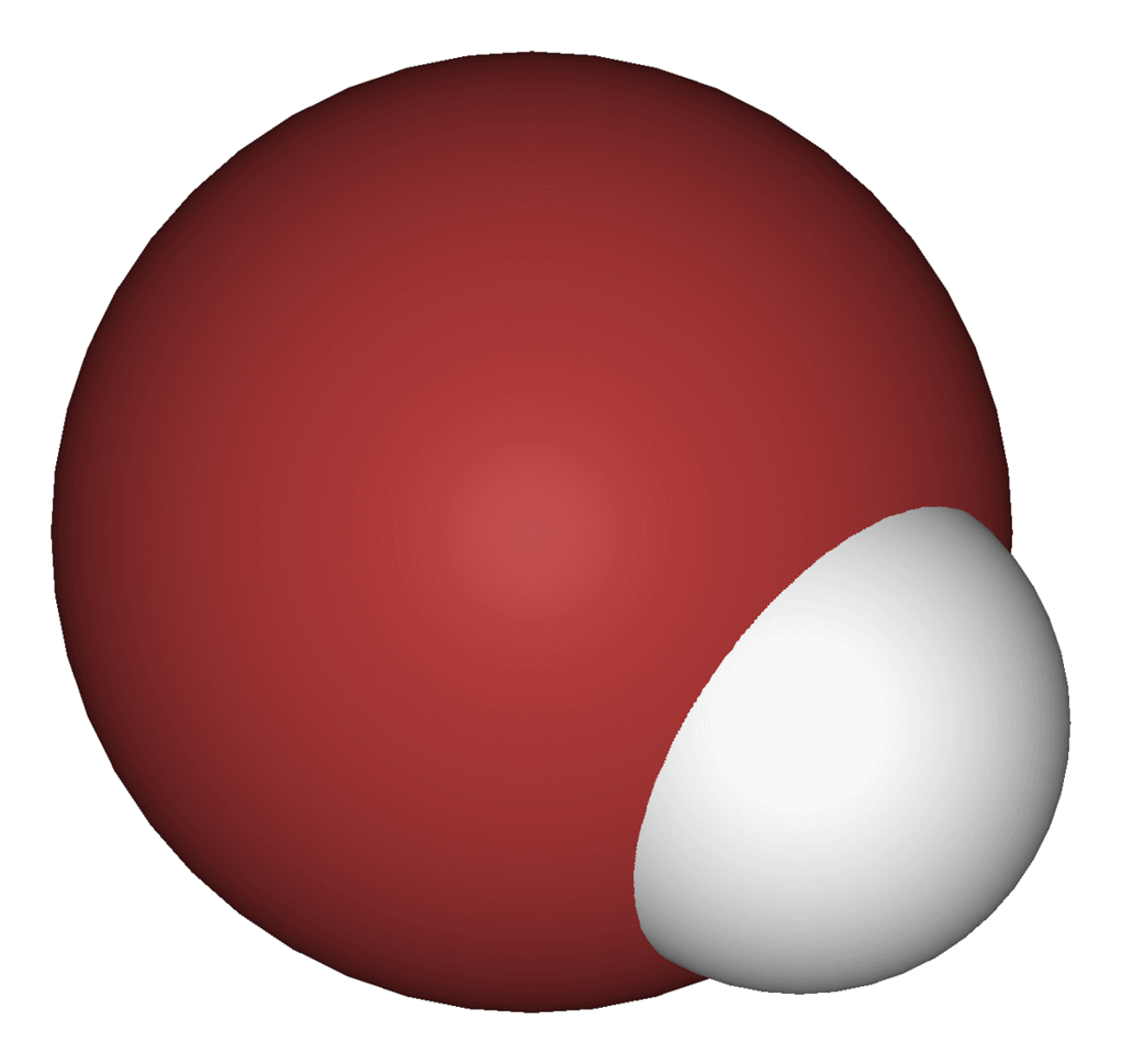
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Apparence | gaz comprime liquefie, incolore, d'odeur acre. | ||
| Propriétés chimiques | |||
| Formule brute | HBr | ||
| Masse molaire | 80,912 ± 0,001 g·mol-1 | ||
| pKa | -9 | ||
| Moment dipolaire | 0,8272 ± 0,0003 D | ||
| Propriétés physiques | |||
| T° fusion | -87 °C | ||
| T° ébullition | -67 °C | ||
| Solubilité | dans l'eau à 20 °C : 1 930 g·l-1 | ||
| Masse volumique | 1,8 g·cm-3 | ||
| Pression de vapeur saturante | à 20 °C : 2 445 kPa | ||
| Point critique | 85,5 bar, 90,05 °C | ||
| Thermochimie | |||
| S0 | 198,7 J/mol·K | ||
| ΔH0 | –36,3 kJ/mol | ||
| ΔH° | 12,69 kJ·mol-1 (1 atm, 25 °C) | ||
| Cp | 29,1 J/mol·K (25 °C) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 35, 37, | |||
| Phrases S : (1/2), 7/9, 26, 45, | |||
| | |||
| |||
| | |||
|
0 3 0 | |||
| | |||


| |||
| | |||


Danger | |||
| Inhalation | toxique | ||
| Peau | Très corrosif | ||
| Yeux | Très corrosif | ||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 2 ppm | ||
| | |||
Le bromure d’hydrogène, de symbole chimique HBr, est un gaz incolore toxique et hautement corrosif, qui forme des fumées blanches au contact de l’humidité. Ces fumées sont constituées d’acide bromhydrique, qui se forme lorsque le bromure d’hydrogène est dissous dans l’eau. Le bromure d’hydrogène est un produit chimique assez utilisé en chimie, dans l’industrie ou dans les laboratoires. Le nom HBr se réfère parfois de manière impropre à l’acide bromhydrique au lieu du bromure d’hydrogène gazeux. Les chimistes parlent également d'acide bromhydrique gazeux ou anhydre pour se référer au bromure d'hydrogène.
Histoire
Le bromure d'hydrogène a été étudié et préparé par le chimiste Antoine-Jérôme Balard lors de sa découverte du brome dans les marais salants près de Montpellier.
Production industrielle
Le bromure d'hydrogène est industriellement produit en petite quantité par rapport au chlorure d'hydrogène et à l'acide chlorhydrique qui sont des produits majeurs de l'industrie chimique. La préparation la plus courante de HBr se fait en mélangeant du dihydrogène et du dibrome à haute température (200 à 400 °C). La réaction est généralement catalysée par du platine.
Synthèse du bromure d'hydrogène
La préparation de HBr se fait à l'aide de nombreuses méthodes.
Une synthèse très simple utilise la réaction entre l'acide sulfurique et le bromure de sodium :
-
- NaBr(s) + H2SO4(aq) → NaHSO4(s) + HBr(g)
Cependant cette synthèse n'a pas un bon rendement car le bromure d'hydrogène formé est oxydé en dibrome par l'acide sulfurique :
-
- 2HBr(g) + H2SO4(aq) → Br2(g) + SO2(g) + 2H2O(l)
Pour cette méthode, des acides non oxydants comme l'acide acétique ou l'acide phosphorique peuvent être utilisés.
La réduction du dibrome par l'acide phosphoreux ou par le dioxyde de soufre permet aussi d'obtenir HBr :
-
- Br2 + H3PO3 + HO- → H2PO4-(s) + 2HBr(g)
- Br2 + SO2 + 2H2O → H2SO4 + 2HBr(g)
Enfin, l'hydrolyse des bromures métalliques permet de former du bromure d'hydrogène, simplement humide et souillé par des traces de corps ayant pris part à la réaction avec un bon rendement. C'est un procédé couramment employé.
Le bromure d'hydrogène entraîne toujours des vapeurs d'eau de dibrome. Ces dernières sont éliminées par une pâte de phosphore rouge et d'eau ou d'acide bromhydrique, rendu perméable par de petits fragments de tube de verre. Sec et sans dibrome, le gaz n'attaque plus le caoutchouc.



















































