Eau de Javel - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Hypochlorite de sodium | |||
|---|---|---|---|
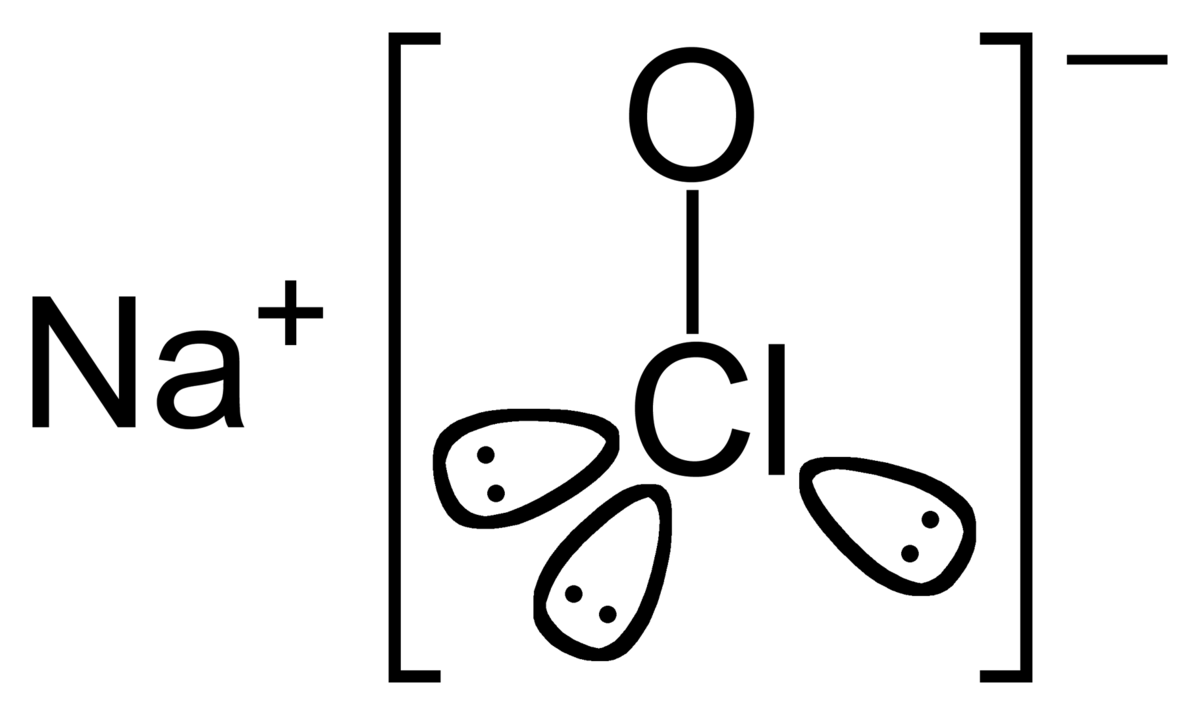
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Oxychlorure de sodium | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | solution limpide, jaunatre, d'odeur caracteristique. | ||
| Propriétés chimiques | |||
| Formule brute | NaClO | ||
| Masse molaire | 74,442 ± 0,002 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -24,5 °C (pentahydrate) | ||
| T° ébullition | 111 °C | ||
| Solubilité | 94,2 g dans 100 g d'eau (à 23 °C) (Pentahydrate) | ||
| Masse volumique | 1,1 g·cm-3 (solution aqueuse, 5,5 %), 1,21 g·cm-3 (solution aqueuse, 14 %) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 31, 34, 50, | |||
| Phrases S : 1/2, 28, 45, 50, 61, | |||
| | |||
| |||
| | |||
|
0 3 2 | |||
| Inhalation | Dangereuse, peut être mortelle | ||
| Peau | Irritant, provoque des brûlures, peut être mortelle | ||
| Yeux | Irritant, provoque des brûlures | ||
| Ingestion | Dangereuse, voire mortelle | ||
| Autre | Intraveineuse : Irritant, provoque des infections | ||
| | |||
L’eau de Javel (appelée aussi Javel) est une solution liquide oxydante fréquemment utilisée comme désinfectant et/ou comme décolorant.
Étudiée particulièrement à partir de 1775 par le chimiste français Claude Louis Berthollet, dont la manufacture de produits chimiques a été construite dans le quartier de Javel à Paris, elle est composée d'hypochlorite de sodium pur (NaClO), en solution aqueuse avec du sel (NaCl), résiduel du procédé de fabrication.
La réaction de fabrication de l'eau de Javel (NaClO) à partir de chlore et de soude (NaOH) est :
Cl2 + 2 NaOH → NaCl + NaClO + H2O.
L'eau de Javel contenant des atomes de chlore, on dit souvent par extension que de l'eau javellisée est « chlorée », terme qui est imprécis, car l'acide chlorhydrique est également une solution chlorée, et l'odeur caractéristique de l'eau de Javel n'a rien à voir avec l'odeur du dichlore.
Historique
Le chlore a été découvert en 1774 par le chimiste suédois Scheele. Claude Louis Berthollet étudie quelques années après les propriétés décolorantes du chlore et en tire un procédé de blanchiment des toiles utilisant une solution de chlorure et d'hypochlorite de potassium : il vient d'inventer la "lessive de BERTHOLLET", bientôt dénommée eau de Javel suite à la localisation de son premier site de production : la manufacture de produits chimiques construite en 1777 dans le village de Javel, à l'ouest de Paris, qui donnera son nom au produit.
L'eau de Javel a rapidement connu un vif succès comme décolorant (Auparavant, les toiles devaient être exposées au soleil pendant des mois pour les blanchir).
En 1820, le pharmacien Antoine Germain Labarraque étudie les qualités désinfectantes des dérivés chlorés et des hypochlorites de potassium et de sodium. Il met au point une solution de chlorure et d'hypochlorite de sodium qu'il appelle « liqueur de Labarraque ». En 1900, on appelait eau de Javel l'hypochlorite de potassium, et eau de Labarraque l'hypochlorite de sodium. Plus tard, le procédé de fabrication a remplacé le potassium par le sodium, sans changement de nom.
À partir du XIXe siècle, l'eau de Javel est couramment utilisée comme désinfectant et pour le traitement de l'eau potable (voir verdunisation).
Les chlorures décolorants, hypochlorites de sodium (eau de Javel) et de calcium (chlorure de chaux), ont été le premier débouché du chlore. Ils étaient obtenus par action du chlore sur les solutions de soude ou sur la chaux éteinte. Le chlore liquide a remplacé peu à peu le chlorure de chaux, qui est un mélange d'hypochlorite de calcium Ca(ClO)2 et de chlorure de calcium CaCl2 utilisé comme agent décolorant actif avant l’eau de Javel (jusqu'en 1925).




















































