Formule de Lewis - Définition
La liste des auteurs de cet article est disponible ici.
Exemples
- Octet respecté
Molécule d'eau
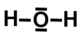
- Octet non respecté par excès
- Lacune (exemple de BH_3)
l'isomérie H-C#N H-(+)N#C(-) montre que des structures de Lewis peuvent parfois aider à déterminer la connectivité d'une molécule.
Différentes approches
Toutes les approches doivent se baser sur un squelette σ bien défini. Il existe différentes stratégies pour obtenir une structure de Lewis valide.
Règle du maximum de liaison
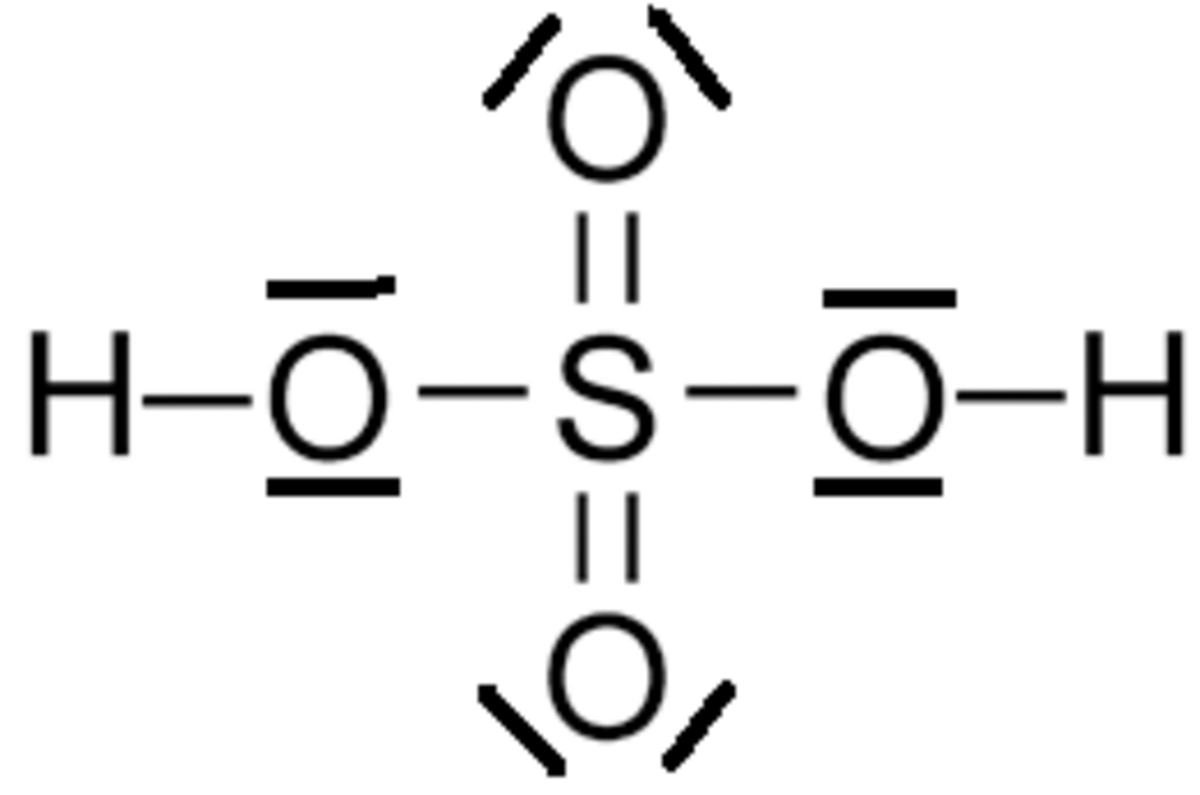
Sur le squelette moléculaire, on distribue les électrons restant de façon à faire un maximum de liaison ... tout en respectant l'octet. Elle consiste à partir des représentations de Lewis des atomes, et à associer les électrons célibataires des atomes en ayant plusieurs pour obtenir le squelette, puis à compléter par les atomes monovalents (H et halogènes) et liaisons multiples. Dans certains cas, deux électrons célibataires peuvent former un doublet non liant (cas des carbènes) ou deux électrons d'un doublet non liant peuvent former une liaison, appelée "covalente dative", ce qui permet de respecter la règle de l'octet, même dans les cas des acides nitrique, phophorique, sulfurique... et de contourner (dans certains cas spécifiques) l'idée d'hypervalence.
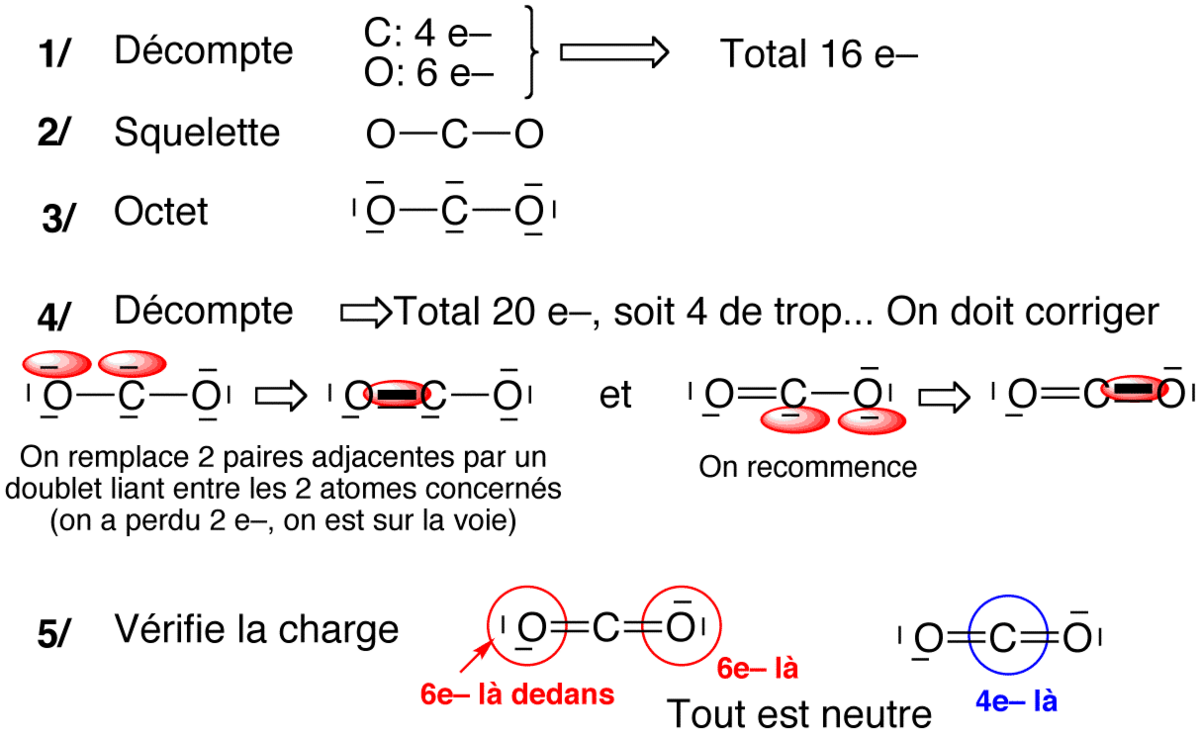
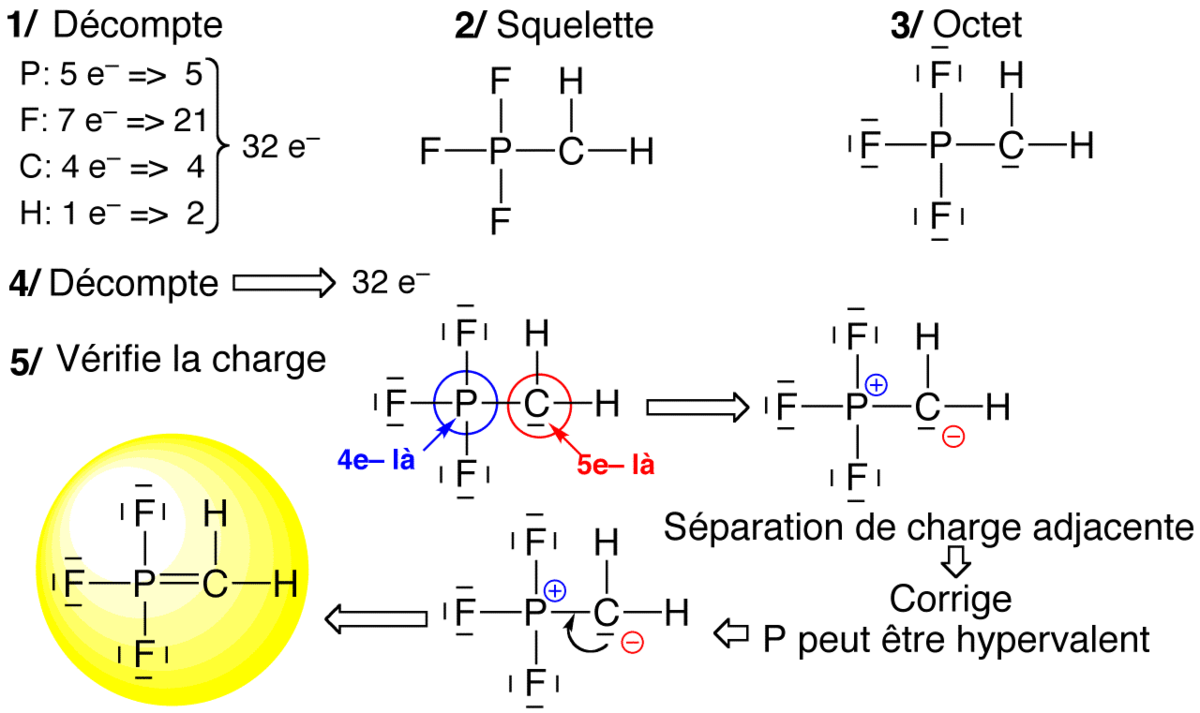
Règle de l'octet à outrance
La règle de l'octet à outrance est l'approche la plus systématique.
Sur le squelette moléculaire, on complète à l'octet tous les atomes (sauf hypovalents notoires) et on réajuste la quantité d'électron de façon à retrouver le nombre d'électron initial. Cette approche se fait en cinq étapes :
- Supposer un squelette (liaison simples)
- Compter le nombre total d'électrons de valence (n)
- Compléter à l'octet partout
- Compter le nombre d'électrons présents dans le schéma trouvé en 3 et comparer à n
- Compter les charges, et réduire l'excès de charge +/- adjacentes en prenant un doublet libre du – et en faisant une liaison multiple vers son voisin + (si ce voisin peut être hypervalent).
Exemples d'application