Linus Pauling - Définition
La liste des auteurs de cet article est disponible ici.
La nature de la liaison chimique
Au début des années 1930, Pauling commence à publier ses travaux sur la nature de la liaison chimique, qui aboutissent à son fameux livre The Nature of the Chemical Bond en 1939. Ce livre est probablement l'un des plus importants livres de chimie jamais publiés. Pour donner une idée de son influence, il suffit de remarquer que dans les 30 années qui ont suivi sa première édition en 1939, il a été cité plus de 16 000 fois ce qui en fait l'ouvrage le plus souvent cité dans la littérature scientifique. Au début du XXIe siècle, plus de soixante ans après sa publication, de nombreux articles scientifiques le citent encore. C'est principalement en récompense de ces travaux qu'il recevra le prix Nobel de chimie en 1954, « ses recherches sur la nature de la liaison chimique et leurs applications à la détermination de la structure de substances complexes ».
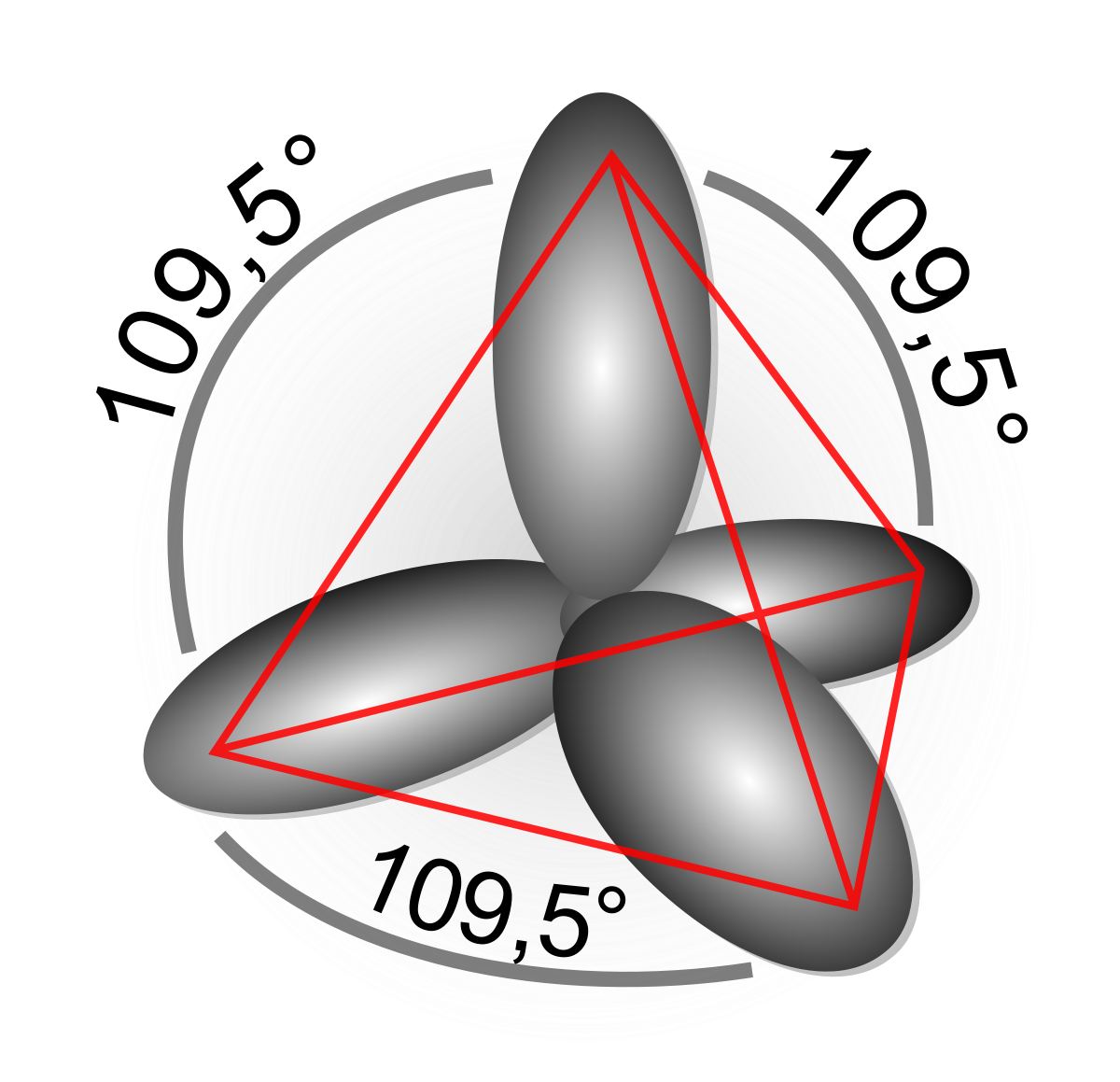
Au cours de ses travaux sur la nature de la liaison chimique, Pauling introduit notamment le concept d'hybridation des orbitales atomiques. Alors que les électrons dans les atomes sont décrits par des orbitales s, p, (…), il montre que pour décrire les liaisons au sein des molécules il est préférable de construire des fonctions qui sont des mélanges de ces orbitales. Par exemple, les orbitales 2p et 2s d'un atome de carbone peuvent se combiner pour former quatre orbitales équivalentes (appelées orbitales hybrides sp³) qui permettent mieux de décrire des composés comme le méthane, à géométrie tétraédrique. De même, l'orbitale 2s peut se combiner avec deux orbitales 2p pour former trois orbitales équivalentes (orbitales hybrides sp²) tandis que la troisième orbitale 2p ne s'hybride pas, ce qui permet de mieux décrire des composés insaturés comme l'éthylène.
L'un des autres domaines auquel il s'intéresse est la compréhension du rapport entre les liaisons ioniques, dans lesquelles les électrons sont transférés d'un atome à l'autre, et les liaisons covalentes, dans lesquelles les électrons sont mis en commun par les atomes. Il montre que ces deux types de liaison sont en réalité des cas extrêmes et que la plupart des liaisons sont en fait un mélange de liaison ionique et de liaison covalente. C'est dans ce domaine que la notion d'électronégativité qu'il développe est la plus utile : la différence d'électronégativité entre deux atomes s'avère être la grandeur la plus pertinente pour prédire le degré d'ionicité d'une liaison.
Le troisième sujet auquel travaille Pauling dans le domaine de la liaison chimique est la compréhension de la structure des composés aromatiques, et notamment du plus simple d'entre eux, le benzène.
Jusque là, la meilleure description de la structure du benzène avait été faite par le chimiste allemand Friedrich Kekulé von Stradonitz. Celui-ci avait décrit cette structure comme résultant de la transition rapide entre deux structures dans lesquelles les liaisons simples et doubles seraient alternées, les liaisons simples venant prendre la place des doubles et réciproquement. Pauling montre qu'une description intermédiaire entre les deux structures, basée sur la mécanique quantique, est plus pertinente : plutôt que deux structures en transition rapide, il s'agit plutôt de la superposition de deux structures. Ce phénomène sera plus tard baptisé du nom de résonance. D'un certain côté, ce phénomène est analogue à celui d'hybridation des orbitales atomiques, puisqu'il consiste en la combinaison de plusieurs structures électroniques : les orbitales atomiques des différents atomes de carbone se combinent entre elles et forment des orbitales moléculaires.