Métal de transition - Définition
La liste des auteurs de cet article est disponible ici.
Couleurs des complexes de métaux de transition
Compte tenu de leur grande variété d'états d'oxydation et donc de configurations électroniques, les métaux de transition forment des composés aux couleurs les plus variées. Tout le spectre visible est couvert, la couleur d'un élément donné dépendant aussi de son état d'oxydation : ainsi le manganèse à l'état d'oxydation +7 est violet (permanganate de potassium) tandis que l'ion Mn2+ est rose pâle.
La coordination d'un ligand est susceptible de modifier les niveaux d'énergie des orbitales d et donc la couleur des composés d'un métal de transition donné.
Les facteurs déterminant la couleur d'un complexe sont :
- la nature de l'ion métallique, en particulier le nombre d'électrons de l'orbitale d dans la couche de valence ;
- la nature des ligands autour de l'ion métallique, ce qui conditionne l'effet sur les niveaux d'énergie des orbitales d ;
- la géométrie de ces ligands autour de l'ion métallique, car des diastéréoisomères peuvent avoir des couleurs différentes.
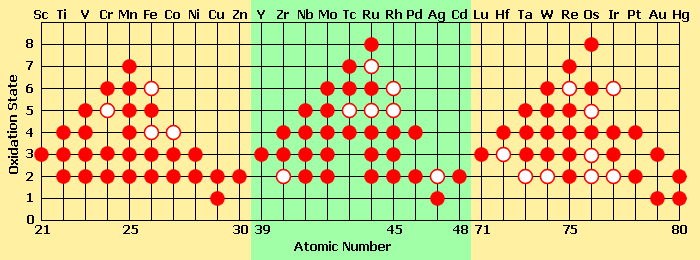
États d'oxydation
Contrairement aux deux premiers groupes du tableau périodique (les métaux alcalins et les métaux alcalino-terreux), les métaux de transition (notamment des groupes 4 à 11) peuvent former des ions avec une grande variété d'états d'oxydation. Les métaux alcalino-terreux tels que le calcium sont stables à l'état d'oxydation +2, alors qu'un métal de transition peut adopter des degrés d'oxydation de -3 à +8. On peut en comprendre la raison en étudiant les potentiels d'ionisation des éléments deux séries. L'énergie requise pour enlever un électron du calcium est faible jusqu'à ce qu'on commence à enlever des électrons sous les deux électrons de sa sous-couche 4s. En fait, Ca3+ a une telle énergie d'ionisation qu'il n'existe pas naturellement. En revanche, avec un élément comme le vanadium, on observe une augmentation linéaire de l'énergie d'ionisation entre les orbitales s et d, ceci étant dû à la très faible différence énergétique entre les sous-couches 3d et 4s. Ainsi, un élément comme le manganèse, avec une configuration [Ar] 4s2 3d5, peut perdre sept électrons et atteindre l'état d'oxydation +7, tandis que le ruthénium et l'osmium atteignent couramment l'état d'oxydation +8 :
Certaines tendances dans les propriétés des métaux de transition peuvent être observées le long d'une période :
- le nombre d'états d'oxydation de chaque ion augmente jusqu'au groupe 7 ou 8, puis diminue ;
- un élément dans un faible état d'oxydation peut se trouver sous forme d'ion simple, mais, pour les états d'oxydation les plus élevés, généralement sous forme d'un composé covalent d'oxygène ou de fluor.
Propriétés
Les métaux de transition ont en général une densité ainsi qu'une température de fusion et de vaporisation élevées, sauf ceux du groupe 12, qui ont au contraire un point de fusion assez bas : le mercure est ainsi liquide au-dessus de -38,8 °C et le copernicium serait peut-être même gazeux à température ambiante. Ces propriétés proviennent de la capacité des électrons de la sous-couche d à se délocaliser dans le réseau métallique. Dans les substances métalliques, plus le nombre d'électrons partagés entre les noyaux est grand, plus grande est la cohésion du métal.
Certains métaux de transition forment de bons catalyseurs homogènes et hétérogènes. Par exemple, le fer est un catalyseur dans le procédé Haber, le nickel et le platine sont utilisés dans l'hydrogénation des alcènes.
Le groupe du platine constitue un ensemble important de métaux de transitions aux propriétés remarquables, qui en font d'excellents catalyseurs aux applications stratégiques.