Azobenzène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Azobenzène | |||
|---|---|---|---|
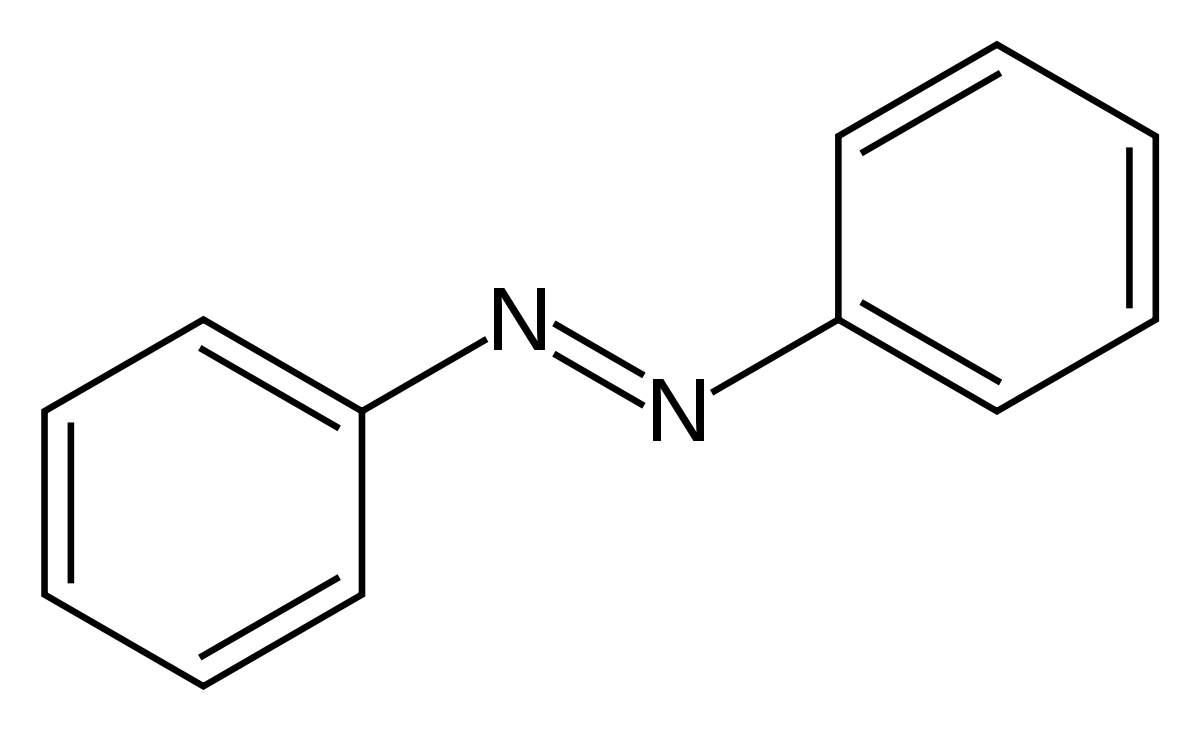
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | (trans) | ||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | cristaux rouge-orangé | ||
| Propriétés chimiques | |||
| Formule brute | C12H10N2 | ||
| Masse molaire | 182,2212 ± 0,0107 g·mol-1 | ||
| pKa | 3,3 | ||
| Propriétés physiques | |||
| T° fusion | 69 °C | ||
| T° ébullition | 293 °C | ||
| Solubilité | Eau : 2,4.10-6 g/100mL (25 °C) Solvants organiques : soluble | ||
| Masse volumique | 1,09 | ||
| Point d’éclair | 476 °C | ||
| Thermochimie | |||
| ΔH0 | 374 kJ/mol | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 20/22, 45, 48/22, 50/53, 68, | |||
| Phrases S : 45, 53, 60, 61, | |||
| | |||
| Produit non classifié | |||
| | |||

Danger | |||
| | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||
| | |||
L'azobenzène est un composé chimique comprenant 2 anneaux phényls liés par un double pont N=N.
Il en existe deux formes isomériques, dépliée dite « trans » et pliée, dite « cis », moins stable, la transition entre les deux formes se fait après absorption d'un photon (photo-isomérisation). Ceci conduit à une réorganisation moléculaire détectable.
En associant des azobenzènes avec des plastiques, on obtient des azopolymères qui conservent les propriétés optiques.
Synthèse
La molécule d'azobenzène est observée pour la première fois en 1856 sous forme de "gelblich-rote krystallinische Blättchen" (flocons jaunes/rouges cristallins). Sa synthèse à l'origine est très proche de celle réalisée aujourd'hui. Selon la méthode de 1858, le nitrobenzène est réduit par de la limaille de fer en présence d'acide éthanoïque. Actuellement on utilise le zinc comme réducteur, en présence d'une base plutôt qu'un acide..
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk
- « azobenzène » sur ESIS, consulté le 17 février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- « Azobenzène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Barillé R, Nunzi JM, Des molécules organisées par la lumière, Pour la Science, avril 2009, p62-68
- # ^ Noble, A. “Zur Geschichte des Azobenzols und des Benzidins” Annalen der Chemie und Pharmacie 1856, Volume 98, p 253-256. doi:10.1002/jlac.18560980211 .
- # ^ Bigelow, H. E.; Robinson, D. B. "Azobenzene" Organic Syntheses, Collected Volume 3, p.103 (1955). http://www.orgsyn.org/orgsyn/pdfs/CV3P0103.pdf



















































