Benzène - Définition
La liste des auteurs de cet article est disponible ici.
Historique
Le benzène a été découvert en 1825 par le scientifique britannique Michael Faraday qui l'isola du pétrole et le baptisa bicarburet of hydrogen. En 1833, le chimiste allemand Eilhard Mitscherlich le produisit par distillation de l'acide benzoïque (composant de la gomme benjoin) et de la chaux. Mitscherlich baptisa ce composé benzin. En 1845, le chimiste britannique Charles Mansfield, travaillant sous la direction d'August Wilhelm von Hofmann, l'isola du goudron de houille. Quatre ans plus tard, il lançait la première production de benzène à l'échelle industrielle à partir de goudron de houille. En 1868, Marcellin Berthelot le synthétise par trimérisation de l'acétylène.
Pendant quelques années, la formule chimique du benzène, C6H6, causa un grand nombre d'interrogations concernant la structure du composé. Plusieurs structures furent proposées successivement sans parvenir à expliquer les propriétés chimiques du composé, parmi lesquelles, par exemple, celle proposée par James Dewar, présentée ci-contre (à gauche), le [3]prismane proposé par Ladenburg, le benzvalène, le benzène Claus, etc.
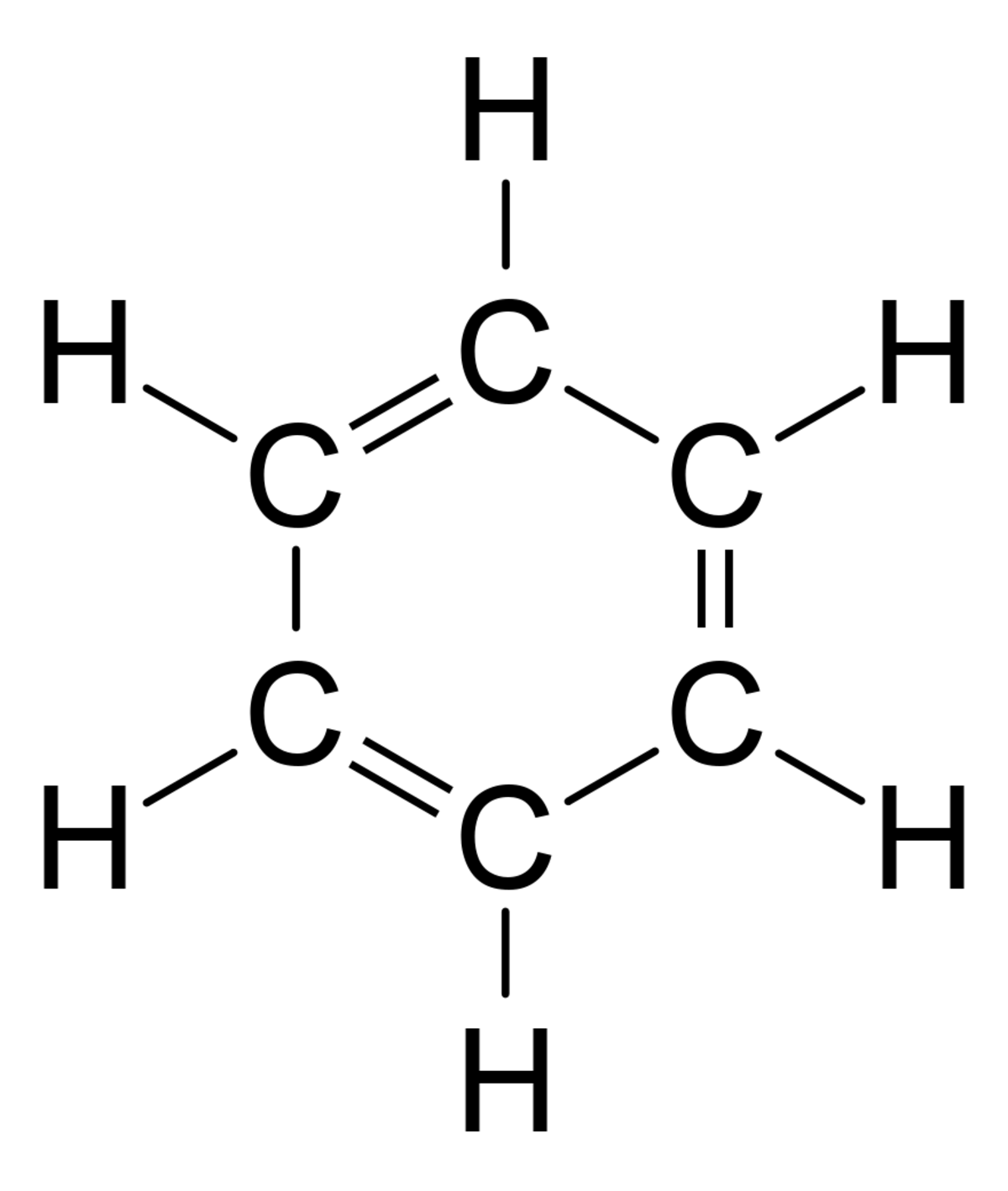
La première forme structurale correcte fut proposée en 1861 par Johann Josef Loschmidt, qui fournit une base à la première interprétation correcte de la structure du benzène proposée par le chimiste allemand Friedrich August Kekulé von Stradonitz en 1865 (à droite). La planéité de ce composé est un des faits particulièrement intéressants de la chimie. Kekulé mit en évidence le fait que plusieurs représentations (dites de nos jours de Lewis) de cette molécule sont équivalentes. Plus précisément, les doubles liaisons peuvent être placées n'importe où sur le cycle, de manière alternée.
Cependant, des chercheurs découvrirent en utilisant la diffraction des rayons X que toutes les liaisons carbone-carbone de la molécule de benzène possèdent la même longueur, ce qui n'est pas compatible avec la représentation ci-contre. En effet, une liaison simple est plus longue qu'une liaison double. De plus, la longueur de liaison dans la molécule de benzène est à la fois plus grande que la longueur d'une liaison double carbone-carbone, et plus faible que celle d'une liaison simple. Tout se passe comme s'il existait une liaison et demie entre chacun des atomes de carbone.
Il faudra attendre la théorie des orbitales hybrides (élaborée par Linus Pauling, prix Nobel de chimie et prix Nobel de la paix, dans sa publication La nature de la liaison chimique) pour expliquer ce fait avec une grande élégance, et ce définitivement. En effet les liaisons chimiques peuvent être décrites avec une approximation raisonnable comme étant formées par des recouvrements d'orbitales atomiques (en méthode CLOA, Combinaison Linéaire d'Orbitales Atomiques, n orbitales atomiques se mélangent pour former n orbitales moléculaires). Les orbitales moléculaires obtenues par cette combinaison linéaire peuvent induire des effets de délocalisation des électrons.
Aromaticité
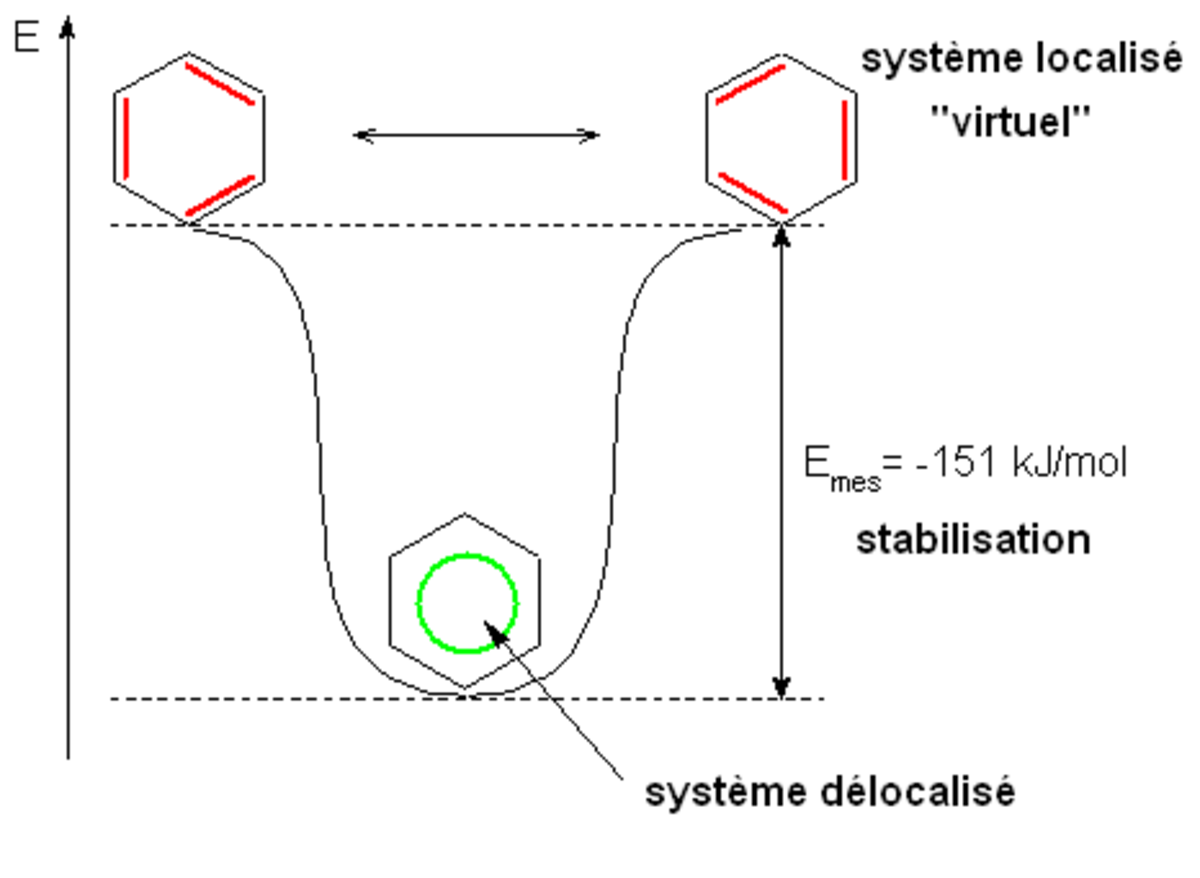
Cette délocalisation des électrons est appelée aromaticité. Elle est responsable de nombreuses propriétés du benzène, et notamment de sa grande stabilité.
Par rapport à un système « virtuel », pour lesquels les liaisons π seraient localisées (chaque liaison localisée entre deux atomes de carbone), le système réel dans lequel les liaisons π sont délocalisées sur la totalité du cycle est stabilisé de plus de 150 kJ⋅mol-1. Les réactions chimiques auxquelles participe le benzène sont donc préférentiellement celles pour lesquelles cette stabilisation est conservée.