Cyclodextrine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Les cyclodextrines ou cycloamyloses sont des molécules-cages d’origine naturelle qui permettent d’encapsuler diverses molécules. Elles ont aujourd’hui d’innombrables applications industrielles, et on les retrouve dans une multitude de produits courants. Elles sont aussi l’objet de très nombreuses recherches scientifiques.
Généralités
Description
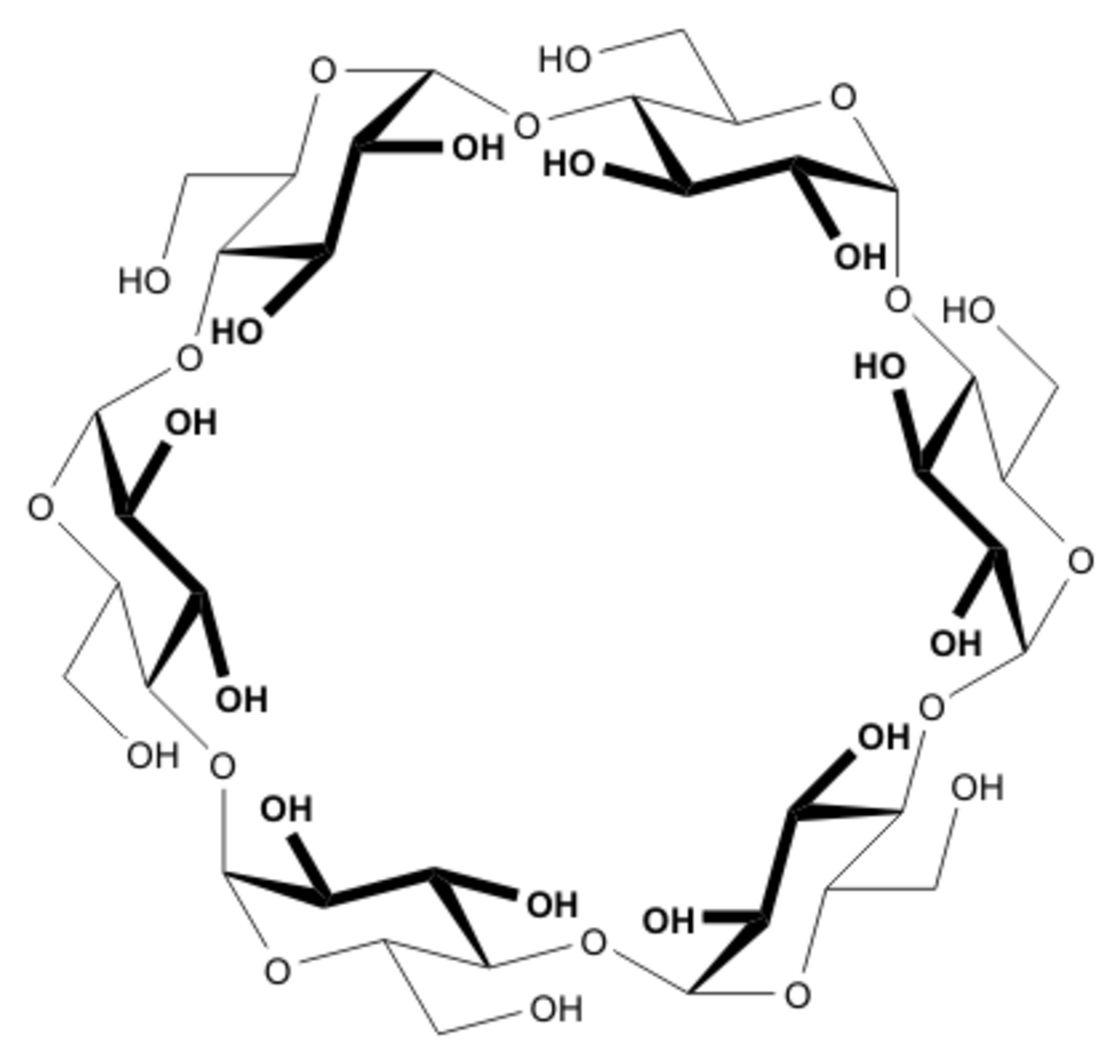
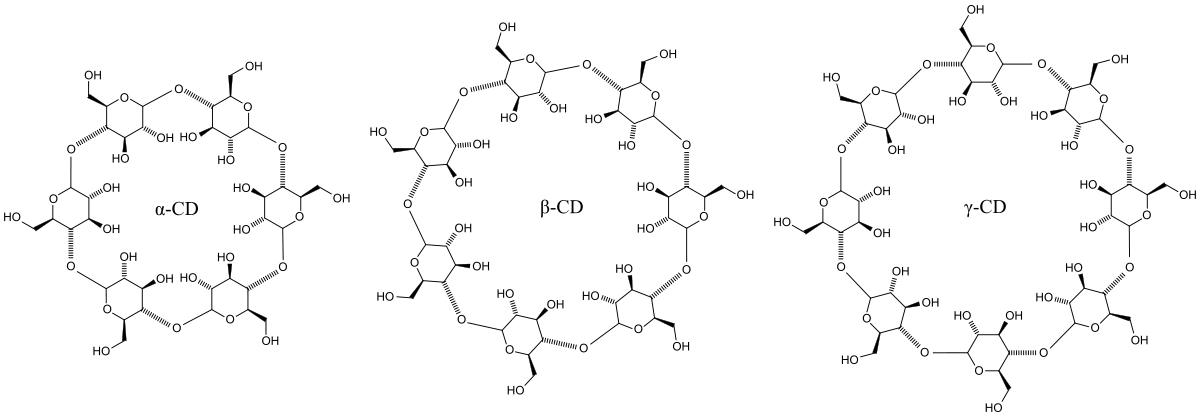
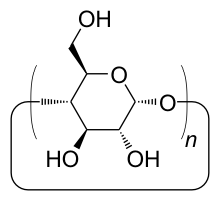
Les cyclodextrines sont une famille d'oligosaccharides cycliques composés de sous-unités glucopyranose liées en α-(1,4). Ces produits naturels résultant de la dégradation de l'amidon par la bactérie Bacillus macerans, ont été découverts en 1891 par Villiers. Trois familles sont principalement utilisées ou étudiées les α-, β- et γ-cyclodextrines formées de 6, 7 ou 8 sous-unités (des familles de plusieurs dizaines de sous-unités ont été synthétisées dans des buts de recherche). Ces dernières années ont vu l’explosion du nombre de recherches concernant cette famille de composés chimiques.
| α-cyclodextrine | β-cyclodextrine | γ-cyclodextrine | |
|---|---|---|---|
| Numéro CAS | |||
| Formule brute | C36H60O30 972,845106 g∙mol-1 | C42H70O35 1 134,985957 g∙mol-1 | C48H80O40 1 297,126808 g∙mol-1 |
| Taille de la cavité | 0,45 nm | 0,70 nm | 0,85 nm |
De nombreux dérivés peuvent être obtenus à partir des cyclodextrines naturelles : les groupements hydroxyles des unités glucopyranose peuvent être aminés, estérifiés ou éthérifiés. La synthèse de ces dérivés a souvent pour but d'améliorer la solubilité. Parmi les cyclodextrines les plus étudiées on trouve la β-cyclodextrine (BCD, naturelle), l'hydroxypropyl-β-cyclodextrine (HPCD) et la méthyl-β-cyclodextrine (MCD). Les molécules chimiquement modifiées ont des masses molaires moyennes correspondant à des indices molaires de substitution.
Toxicité
En général les cyclodextrines et leurs dérivés hydrophiles sont considérés comme pratiquement non-toxiques en administration par voie orale. En effet ces molécules ne diffusent quasiment pas au travers des membranes biologiques et ne sont pas absorbées lors du transit intestinal (DL50 oral, rat 18 800 mg/kg pour la β-cyclodextrine, d'après MSDS). Ainsi dans un rapport de 1995, fondé sur celui de 1993, l’OMS (Joint FAO/WHO Expert committee, 1993, 1995), donnait une Dose Journalière Admissible de 5 mg par kg de masse corporelle pour la BCD, fondé sur une dose sans effet nocif (NOEL) de 1,25% dans le régime alimentaire chez le chien (coefficient de sécurité de 200). La FDA (Food and Drugs Agency) autorise son utilisation comme additif alimentaire à hauteur de 0,5 à 2% selon les produits. La BCD est ainsi utilisée dans l’industrie agro-alimentaire comme additif alimentaire (E459).
Ces molécules peuvent être considérées comme éco-compatibles et se dégradent dans le milieu naturel. Toutefois la cyclodextrine naturelle se dégrade plus facilement que les cyclodextrines modifiées : 82% de biodégradation de la BCD en 28 jours mais seulement 9% pour la HPCD et 9% pour la MCD.
Propriétés remarquables
Les cyclodextrines possèdent une structure en tronc de cône, délimitant une cavité en leur centre. Cette cavité présente un environnement carboné apolaire et plutôt hydrophobe (squelette carboné et oxygène en liaison éther), capable d'accueillir des molécules peu hydrosolubles, tandis que l'extérieur du tore présente de nombreux groupements hydroxyles, conduisant à une bonne solubilité (mais fortement variable selon les dérivés) des cyclodextrines en milieu aqueux. En particulier la β-cyclodextrine naturelle est près de dix fois moins soluble que l'alpha ou la gamma. Grâce à cette cavité apolaire, les cyclodextrines sont capables de former des complexes d'inclusion en milieu aqueux avec une grande variété de molécules-hôtes hydrophobes. Une ou plusieurs molécules peuvent être encapsulées dans une, deux ou trois cyclodextrines.
La formation de complexe suppose une bonne adéquation entre la taille de la molécule hôte et celle de la cyclodextrine. L'intérieur de la cavité apporte un micro-environnement lipophile dans lequel peuvent se placer des molécules non polaires. La principale force provoquant la formation de ces complexes est la stabilisation énergétique du système par le remplacement dans la cavité des molécules d'eau à haute enthalpie par des molécules hydrophobes qui créent des associations apolaires-apolaires. Ces molécules hôtes sont en équilibre dynamique entre leur état libre et complexé. La résultante de cette complexation est la solubilisation de molécules hydrophobes très insolubles dans la phase aqueuse. Ainsi les cyclodextrines sont capables de complexer en milieu aqueux et ainsi solubiliser les composés hydrophobes (la polarité de la cavité est comparable à celle d'une solution aqueuse d'éthanol).