Équation chimique - Définition
La liste des auteurs de cet article est disponible ici.
Description
Chaque molécule est représentée par sa formule chimique : brute, semi-développée ou développée plane (voir aussi l'article sur la représentation des molécules). Les atomes d'une molécule sont écrits groupés, le nombre d'atomes au sein de la molécule est indiqué après le symbole chimique, en indice, par exemple : la molécule d'eau H2O est composée de deux atomes d'hydrogène et d'un atome d'oxygène. Pour un cristal monoatomique, on note simplement l'atome, par exemple Fe pour un cristal de fer. Si un cristal est composé de plusieurs espèces chimiques, on indique une maille (ou une sous-maille) comme une molécule, par exemple Al2O3 pour un cristal d'alumine.
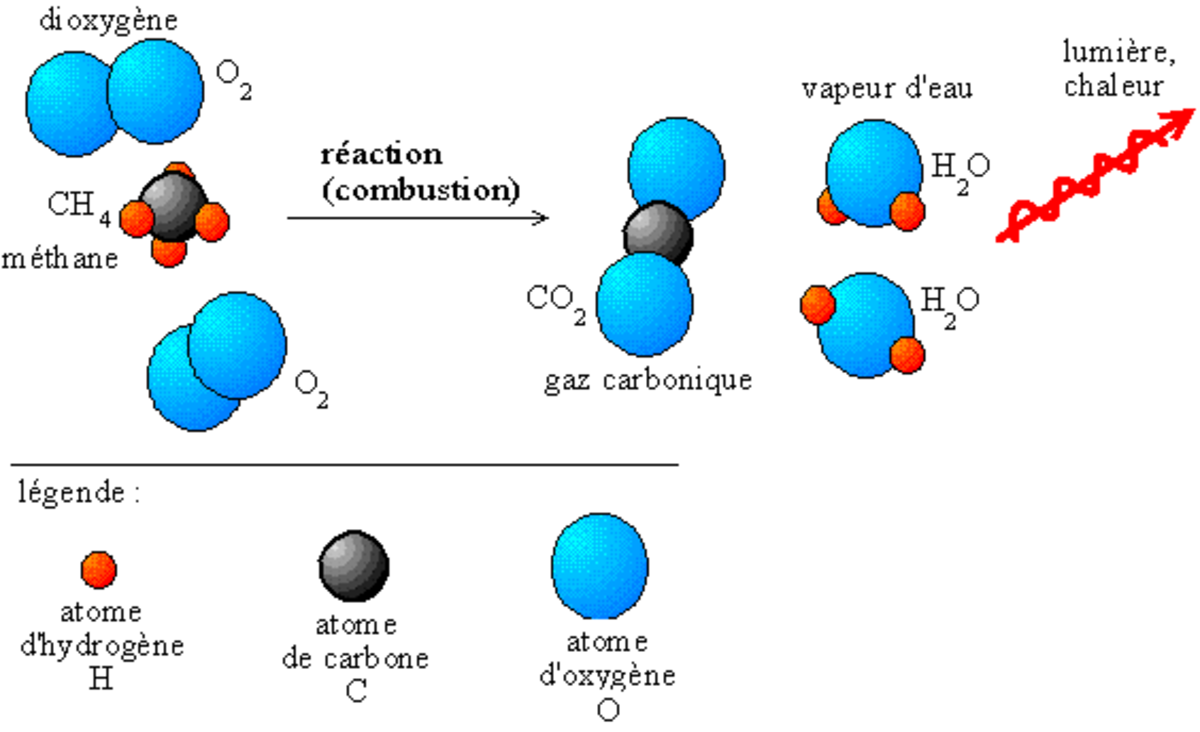
La réaction chimique est représentée par une flèche allant vers la droite, certains préconisent son remplacement par le signe égal mais celui-ci, qui est une relation d'équivalence, ne rend pas compte de la notion d'écoulement du temps c'est-à-dire de la distinction entre réactifs et produits. Les réactifs sont indiqués à gauche de la flèche, les produits de réaction à droite. S'il faut plusieurs molécules de même nature pour la réaction, on indique ce nombre (entier) avant la molécule ; ce nombre est appelé « coefficient stœchiométrique ». Par exemple, l'équation chimique de la combustion complète du méthane dans le dioxygène est
- CH4 + 2O2
→CO2 + 2H2O
Le bilan du nombre d'atomes à gauche et à droite doit être équilibré (ci-dessus : de chaque côté de la flèche, on a un atome C, quatre atomes H et quatre atomes O).
Les coefficients stœchiométriques sont donc des entiers. Cependant, pour simplifier l'écriture dans certains cas, on divise tous les coefficients par un même entier, on a donc des coefficients fractionnaires, mais il s'agit d'un artifice de notation.
Si la réaction peut se faire dans les deux sens (équilibre), on note deux flèches superposées, une allant vers la droite, l'autre vers la gauche : « ⇆ » ou « ⇋ ». Lorsque ce caractère n'est pas disponible, on utilise un signe égal « = » ou parfois une double flèche « ↔ » (bien que cette notation ne soit pas très répandue). Par exemple, la dissociation de l'eau peut être notée par
- 2H2O
⇆H3O+ + OH- - ou
- 2H2O = H3O+ + OH-
- ou
- 2H2O ↔ H3O+ + OH-
Les signes « + » et « - » en exposant indiquent la charge portée par les ions.
Dans le cas de réactions en phase solide, on utilise la notation de Kröger et Vink.
Anecdote
La découverte de la notion de stœchiométrie, c'est-à-dire le fait que les produits chimiques réagissent en proportions entières, par John Dalton en 1804, fut l'un des arguments décisifs en faveur de la théorie atomique de la matière.