Oxyde d'éthylène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Oxyde d'éthylène | |||
|---|---|---|---|
| |||
| Général | |||
| Synonymes | 1,2-Époxyéthane ; Oxirane | ||
| No CAS | |||
| No EINECS | |||
| FEMA | |||
| Apparence | gaz comprimé liquefié incolore, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
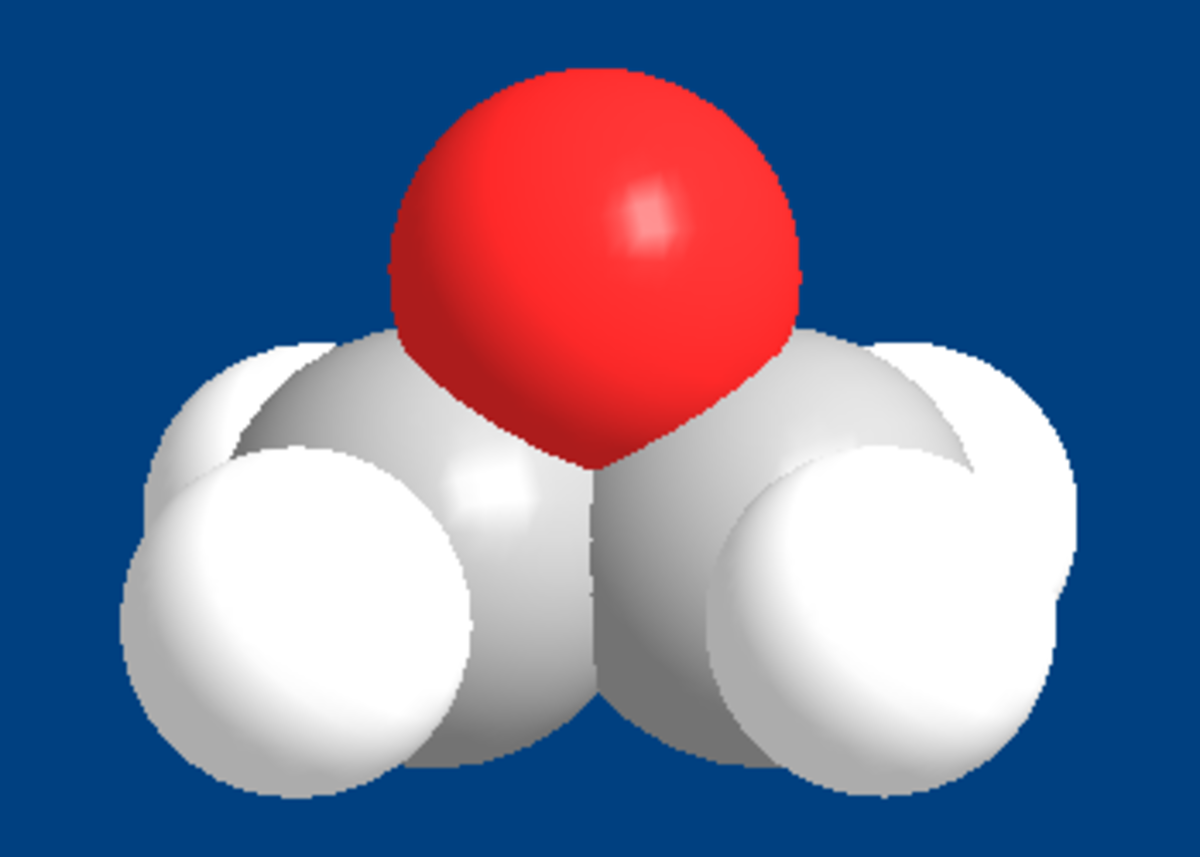
| Formule brute | C2H4O | ||
| Masse molaire | 44,0526 ± 0,0022 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -111 °C | ||
| T° ébullition | 11 °C | ||
| Solubilité | dans l'eau : miscible | ||
| Masse volumique | 0,877 g·cm-3 (7°C) | ||
| T° d’auto-inflammation | 429 °C | ||
| Point d’éclair | -20 °C | ||
| Limites d’explosivité dans l’air | 3–100 %vol | ||
| Pression de vapeur saturante | à 20 °C : 146 kPa | ||
| Point critique | 71,9 bar, 195,85 °C | ||
| Thermochimie | |||
| S0 | 243 J/mol·K | ||
| S0 | 149,45 J/mol·K | ||
| ΔH0 | -51,08 kJ·mol-1 | ||
| ΔH0 | -96 kJ/mol | ||
| Cp | 86.9 J/mole·K (liquide) | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,56 ± 0,01 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 12, 23, 36/37/38, 45, 46, | |||
| Phrases S : 45, 53, | |||
| | |||
| |||
| | |||
|
4 3 3 | |||
| | |||





| |||
| | |||



Danger | |||
| | |||
| Groupe 1 : Cancérogène pour l'homme | |||
| Inhalation | irritation des poumons, convulsions | ||
| Yeux | dangereux | ||
| Écotoxicologie | |||
| LogP | -0,3 | ||
| Seuil de l’odorat | bas : 257 ppm haut : 690 ppm | ||
| | |||
L'oxyde d'éthylène, ou 1,2-époxyéthane, oxyde de diméthylène, oxacyclopropane, ou encore oxirane est un composé organique, le plus simple de la classe des époxydes. Il est important pour l'industrie chimique, entre autres dans la production d'éthylène glycol, ainsi que dans les industries pharmaceutique et agroalimentaire.
Histoire
L'oxyde d'éthylène fut synthétisé pour la première fois par Charles Wurtz en 1859, en faisant réagir du 2-chloroéthanol avec une base. Il prit vraiment une importance aux yeux des industriels durant la Première Guerre mondiale, où il servit à fabriquer l'éthylène glycol (en tant que réfrigérant) et le gaz moutarde.
En 1931, Théodore Lefort découvrit une autre méthode de synthèse, directement à partir d'éthylène et de dioxygène réagissant grâce à un catalyseur à base d'argent. Depuis les années 1940, c'est cette méthode qui sert à produire quasiment tout l'oxyde d'éthylène industriel.