Toxine botulique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Toxine botulique | |
|---|---|
| |
| Général | |
| No CAS | |
| Code ATC | M03 |
| DrugBank | |
| PubChem | |
| Propriétés chimiques | |
| Formule brute | C6760H10447N1743O2010S32 |
| Masse molaire | 149 320,833 ± 7,251 g·mol-1 |
| | |
La toxine botulique est une toxine sécrétée par Clostridium botulinum, la bactérie responsable du botulisme (toxi-infection alimentaire généralement contractée lors de la consommation de conserves et responsable de paralysies musculaires). Il s'agit d'une protéine dont les propriétés neurotoxiques en font le plus puissant poison connu (40 000 000 de fois plus que le cyanure). La toxine est thermolabile et résistante aux acides et aux sucs digestifs.
Les différents types de toxine botulique
On distingue sept types de Clostridium botulinum qui diffèrent par les propriétés antigéniques des toxines qu'elles produisent (A, B, C, D, E, F et G). Ces 7 toxinotypes sont associés à des protéines non toxiques (ANTPs). Le botulisme humain est associé aux types A, B et E et exceptionnellement aux types C et F alors que les types C et D sont essentiellement responsables du botulisme animal. Le botulisme de type A est le plus grave et est souvent mortel car la toxine correspondante est la plus active de toutes les toxines. Le type G a été retrouvé uniquement dans le sol.
D'après leurs caractères phénotypiques, les souches de Clostridium botulinum sont distinguées en quatre groupes :
- Les souches du groupe I sont protéolytiques et elles peuvent produire une toxine de type A, B ou F ou un mélange de toxines (A+B, A+F ou B+F).
- Les souches du groupe II sont non protéolytiques et elles peuvent produire une toxine de type B, E ou F.
- Les souches du groupe III sont non protéolytiques et elles peuvent produire une toxine de type C ou D.
- Les souches du groupe IV sont protéolytiques, elles peuvent produire une toxine de type G.
Structure de la toxine botulique
Structure générale
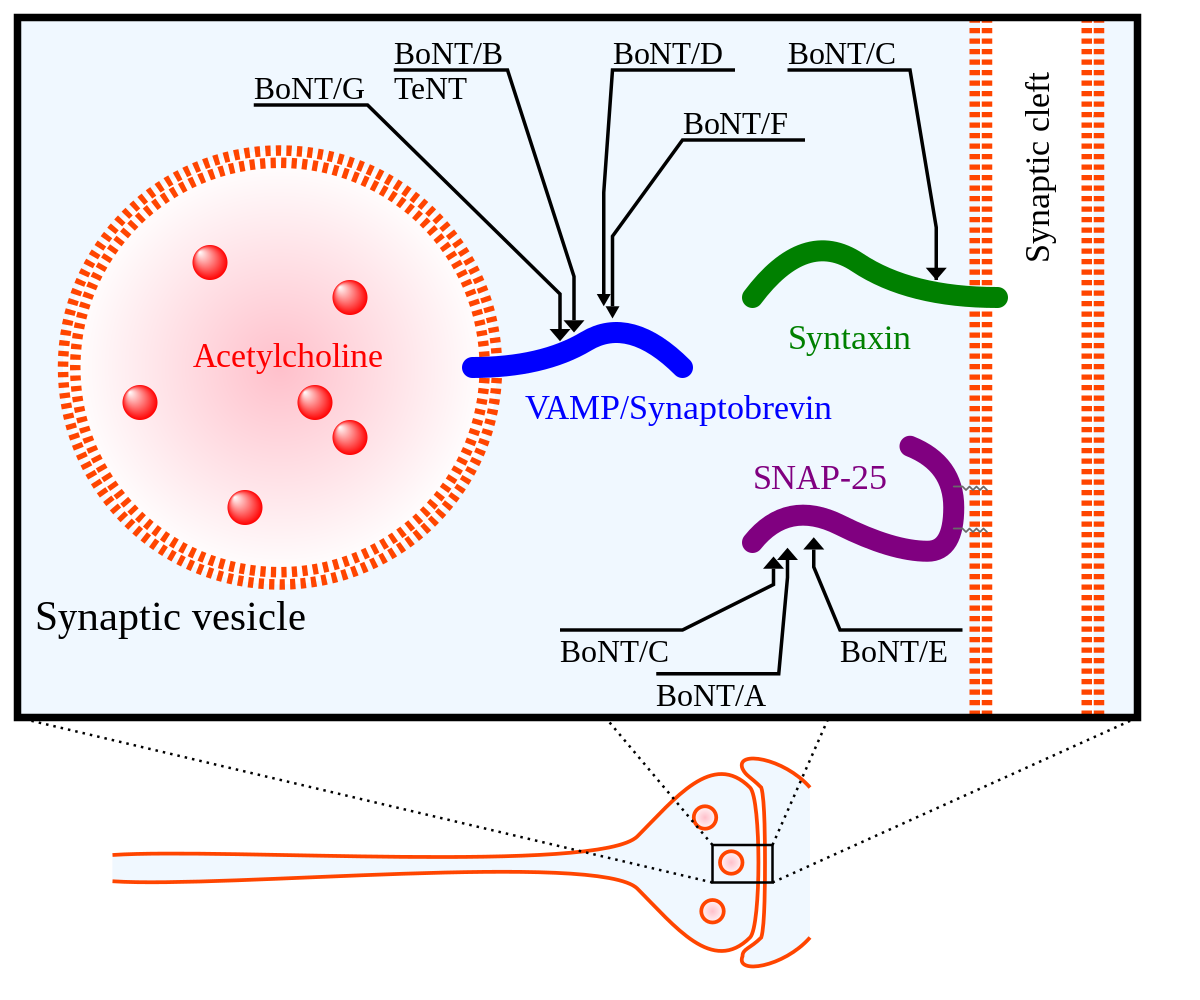
La toxine est un polypeptide à deux chaînes, une lourde (H : Heavy) et une légère (L : Light). La chaîne lourde de 100 kDa est liée à une chaîne légère 50 kDa par un pont disulfure. La chaîne lourde lie la molécule de toxine sur le récepteur neuronal et permet alors la translocation de la chaîne légère, qui porte l'activité enzymatique de la molécule de toxine. Cette chaîne légère est une enzyme (une protéase) qui attaque le complexe SNARE aux jonctions neuromusculaires, empêchant des vésicules de fusionner à la membrane pour libérer l’acétylcholine.
La toxine est synthétisée sous forme d’un monomère d'un poids moléculaire de 150 000 Daltons, elle est inactive sous cette forme. Ce monomère est composé de trois domaines. Un domaine avec une activité protéase (endopeptidase à zinc), un domaine de translocation et un domaine de liaison. Le domaine de translocation est responsable de la translocation de la chaine légère qui possède l’activité protéase dans le cytoplasme de la synapse du neurone cible. Le domaine de liaison est composé de deux sous domaines de taille équivalente. Le sous domaine HC-N a une structure similaire aux protéines qui lient les sucres. Le sous domaine HC-C est replié de façon similaire aux protéines connues pour être impliquées dans des fonctions de liaison protéine/protéine. Ce motif contient plus précisément une structure en β-trefoil qui est présente dans plusieurs protéines impliquées dans la reconnaissance et la liaison de protéines comme IL-1, des facteurs de croissance ou d’inhibiteur de trypsine… Une telle structure va permettre la liaison avec la membrane pré-synaptique par l’intermédiaire d’une double interaction entre deux molécules différente.
La chaîne inactive de 150 kD de la neurotoxine est activée par une protéolyse spécifique de la boucle exposée qui contient le pont disulfure reliant la chaîne légère et la chaîne lourde. Plusieurs protéinases endogènes (de la bactérie) ou exogènes (des tissus) peuvent aussi bien activer cette toxine. La chaîne lourde et la chaîne légère restent associées par des liaisons non covalentes de type protéine/protéine et par le pont disulfure au niveau de la boucle de clivage. Mais pour que le site actif situé sur la chaîne légère soit opérationnel, il faudra rompre le pont disulfure. Cela est réalisé au moment de la translocation.
Nous allons plus particulièrement nous intéresser à la toxine botulique B (BoNT/B).
Liaison de la toxine botulique sur la synapse neuronale
Des études ont démontré la fixation de la BoNT/B sur la synaptotagmine. Notamment des études de cristallographie montrant la liaison de la BoNT/B sur la partie extra cellulaire de la synaptotagmine par l’intermédiaire d’un ganglioside. C’est la chaine lourde qui possède le domaine de liaison à la synaptotagmine.
Internalisation de la toxine dans la synapse
Des études d’immunofluorescence ont montré que la toxine et la synaptotagmine sont co-internalisées par endocytose lorsque cette première est recyclée par la cellule.
Translocation de la chaîne légère de la toxine dans le cytosol de la synapse
La BoNT/B va donc se retrouver dans une vésicule de la cellule. Ces vésicules vont former un endosome qui va s’acidifier grâce à des pompes à protons. Cette acidification va provoquer un changement de conformation du domaine de translocation (N-Terminal) de la chaîne lourde de la toxine, ce qui facilite la libération de la chaîne légère dans le cytoplasme. Plus précisément, la baisse du pH permet aux chaînes lourdes de former un tétramère qui s’insèrent dans la membrane de la vésicule pour former des pores. Ce sont sept hélices du domaine de translocation qui permettent la formation de ces pores qui permettront à la chaîne légère de traverser la bicouche lipidique. En effet, l’acidification de la vésicule provoque également la dénaturation de la chaîne légère qui passe d'une forme hydrophile globulaire à une forme globulaire fondue dont les segments hydrophobes sont exposés en surface ce qui permet son insertion. La chaîne légère se détache de la chaîne lourde par réduction du pont disulfure. Ce fondue globulaire a un diamètre inférieur au diamètre du pore formé par la chaîne lourde (15 Å). Après exposition au pH neutre du cytosol, la chaîne légère se renature dans le cytosol et retrouve son activité endopeptidase. Ces observations sur la translocation de la BoNT/A peuvent être appliquées aux autres sérotypes de la toxine botulique.
L’action de la toxine botulique sur le complexe SNARE
La toxine botulique, une fois entrée dans le cytoplasme de la synapse, va se fixer sa cible : le complexe SNARE. Les différentes toxines (A à G) agissent sur des protéines différentes ou sur des parties différentes des protéines du complexe SNARE.
Activité endopeptidase à zinc de la toxine botulique
La toxine botulique est une endonucléase à zinc. Une comparaison de séquence a montré une séquence hautement conservée de 20 acides aminés localisés dans le milieu de la chaîne légère. Cette séquence contient le motif d’une endopeptidase à zinc : His-Glu-Xaa-Xaa-His. Ce motif lie un atome de zinc. Des mesures physicochimiques ont montré que ces neurotoxines contiennent une seule molécule de zinc par toxine (sauf le BoNT/C qui en contient deux) qui lie la chaîne légère. Des modifications chimiques et des expériences de mutagénèse dirigée avec ces neurotoxines ont montré que deux résidus d’histidine et un résidu de glutamate sont des ligands de l’atome de zinc. Ce zinc est coordonné par l’His 229, l’His 233 et le Glu 267 chez BoNT/B. Un quatrième ligand : une molécule d’eau permet l’hydrolyse de la liaison peptidique du substrat. Des molécules de calcium ont également un rôle dans l’activité de ces toxines.
Plus précisément, le domaine catalytique est un globule compact composé d’un mélange d’hélices α et de feuillets β. L’atome de zinc est situé à l’intérieur d’une grande cavité ouverte qui possède un potentiel électrostatique négatif élevé. Ce site catalytique est protégé par deux régions ceintures de part et d’autre de la cavité. Ce site catalytique est également protégé par le domaine de translocation lorsque celui-ci est relié à la chaine légère.