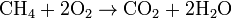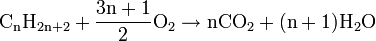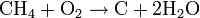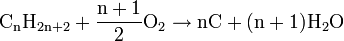Alcane - Définition
La liste des auteurs de cet article est disponible ici.
Réactions chimiques des alcanes
Les alcanes existent en grande quantité sous forme de gisements naturels de gaz ou de pétrole. L'origine de ces gisements est attribuée à la fermentation de la cellulose des végétaux des temps préhistoriques.
Le gaz naturel est essentiellement constitué de méthane et les pétroles contiennent un mélange d'hydrocarbures (dont des alcanes allant de CH4 à C40H82).
Le méthane, l'éthane, le propane et le butane sont des gaz à température ambiante.
À partir de C5, on rencontre des liquides et à partir de C17 des solides.
Les alcanes liquides ou solides ont une densité assez faible (environ 0,7). Comme tous les hydrocarbures, ils sont insolubles dans l'eau ; par contre, ils sont miscibles avec la plupart des liquides organiques et sont eux-mêmes des solvants pour de nombreux composés organiques.
D'une façon générale, les alcanes sont assez peu réactifs, autrement dit stables. Ceci s'explique par le fait que les liaisons C-C et C-H sont assez fortes :
- C-C = 82,6 kcal/mol
- C-H = 100 kcal/mol
- (1 cal = 4,18 J)
Les alcanes peuvent réagir dans plusieurs réactions :
- Réaction de combustion : on brise la liaison C-C (le squelette de la molécule). Il en existe deux types (Exemple avec du méthane):
- la complète qui produit du dioxyde de carbone et de l'eau
- l'incomplète qui produit du carbone (solide) et de l'eau
- Réaction de substitution : on brise la liaison C-H (on substitue H par un autre élément) Exemple: chloration du méthane
-
-
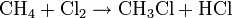
-
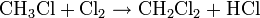
-
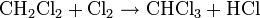
-
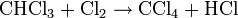
-
- Réaction de déshydrogénisation: on créé une double liaison entre 2 carbones ( C=C ) de la chaînes en brisant la liaison de 2 H. Le produit resultant est un alcène.
La réaction de combustion des alcanes n'a pas un grand intérêt au niveau chimique car la molécule est complètement détruite. Par contre cette combustion a un grand intérêt pratique puisque les alcanes peuvent être utilisés comme carburant ou combustible du fait que cette réaction est très exothermique (elle libère de la chaleur).
Formule développée de l'éthane:
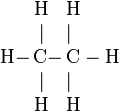
En formule semi-développée : CH3 − CH3