Céramique technique - Définition
La liste des auteurs de cet article est disponible ici.
Méthodes de caractérisation
Les méthodes de caractérisation des céramiques, de la poudre initiale au produit fritté, sont nombreuses : les techniques d'analyse de surface (RX, MEB, MET, MFA...), la mesure de la granulométrie, la surface spécifique, la densité, la porosité, la résistance mécanique, les mesures rhéologiques et les analyses thermiques.
Diffraction des Rayons X
C'est est une technique d'analyse basée sur la diffraction des rayons X sur la matière. Elle permet, dans le cas des céramiques, de savoir si on a obtenu la phase désirée et si la réaction a bien eu lieu.
Microscopie Électronique à Balayage (MEB)
C'est une technique de microscopie électronique basée sur le principe des interactions électrons-matière. Elle permet, dans le cas des céramiques, de connaître la morphologie de la surface et de savoir si le frittage a eu lieu. Elle permet de voir par ailleurs que le frittage n'est jamais complet et qu'il reste toujours des microfissures appelées porosité résiduelle entre les plaques consolidées, ce qui rend les objets faits par voie céramique conventionnelle, cassants.
Microscopie Électronique en Transmission (MET)
C'est une technique de microscopie où un faisceau d'électrons est « transmis » à travers un échantillon très mince, elle est donc particulièrement indiquée pour l'analyse des céramiques en couches très minces issues de l'ablation laser par exemple.
Microscopie à Force Atomique (MFA)
C'est une technique de microscopie à champ proche, une sonde scanne la surface et est attirée ou repoussée selon la charge de la surface. Elle est donc particulièrement appropriée pour analyser les couches minces des oxydes à propriétés magnétiques.
Oxydes technologiques
Les oxydes technologiques sont une catégorie des céramiques techniques, ils sont composés majoritairement d'éléments métalliques et d'oxygène. Par exemple : Al2O3, Fe2O3, MgAl2O4, CoFe2O4, BaTiO3, TiO2...
Oxydes à propriétés magnétiques
Oxydes technologiques présentant des propriétés magnétiques ou ferromagnétiques. La première céramique magnétique à avoir été découverte est la magnétite Fe3O4.
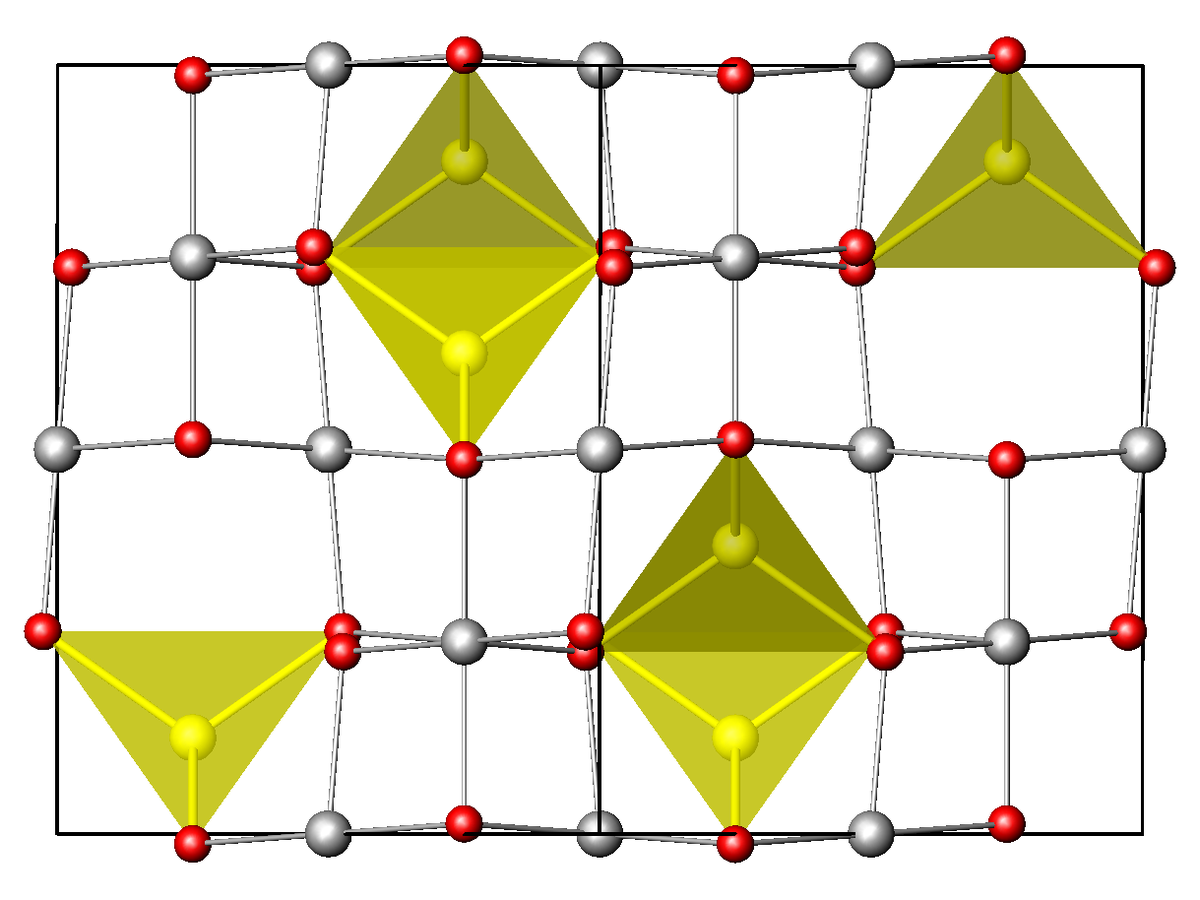
Structure
Le structure la plus commune des oxydes technologiques à propriétés magnétiques est la structure spinelle où les anions forment un empilement compact de géométrie cubique à faces centrées ou hexagonal compact et les cations se placent dans les lacunes tétraédriques ou octaédriques selon leur taille. Elle est de la forme A(B)2O4 avec en rouge les métaux occupant les sites tétraédriques et en vert ceux octaédriques. Il existe deux types de structures spinelles :
- Spinelle directe : A2+(B3+)2O4. Exemple : MgAl2O4, Mg2+(Al3+)2O4
- Spinelle inverse : A3+(B2+A3+)O4. Exemple : CoFe2O4, Fe3+(Co2+Fe3+)O4
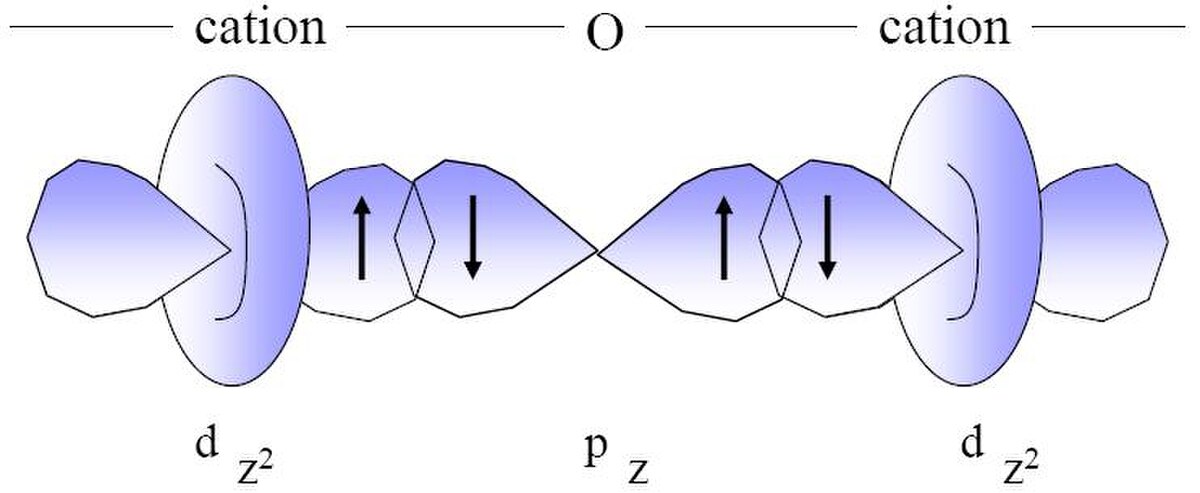
Origine des propriétés magnétiques
Le magnétisme de ces matériaux à pour origine le moment magnétique porté par les atomes qui a deux composantes : le moment magnétique de spin et le moment magnétique orbitalaire.
Chaque cation métallique porte un moment magnétique dû au spin de ses électrons de valence. Par exemple le Fe3+ est un métal de type d5 et à haut spin, ce qui fait que son moment magnétique vaut, approximativement, 5µB (où µB est le magnéton de Bohr). Or à cet effet s'ajoute l'effet du superéchange qui résulte du couplage antiferromagnétique induit par l'oxygène entre les cations dans les lacunes tétraédriques et ceux dans les lacunes octaédriques. Ce couplage est antiferromagnétique parce que l'oxygène implique que les spins de ces deux types de cations soient opposés. Mais la valeur absolue des deux moments magnétiques cationiques n'étant pas identique, le moment magnétique résultant n'est pas nul, par conséquent le matériau est magnétique. Exemple de la magnétite : Fe3O4. Sa structure est de type spinelle inverse : Fe3+(Fe2+Fe3+)O4. Le moment magnétique de Fe3+ vaut 5µB, de même le moment magnétique de Fe2+ vaut 4µB. À cause du superéchange le moment magnétique total vaut : 5μB + 4μB − 5μB = 4μB car les moments magnétiques des deux types de cations sont opposés.
Applications
Les applications des oxydes technologiques à propriétés magnétiques dépend en particulier de leur mise en forme.
- Couches minces : enregistrement magnétique (bandes magnétiques...)
- Films minces : stockage information (disque durs, CD...)
Oxydes à propriétés piézoélectriques
Les oxydes technologiques présentant des propriétés piézoélectriques, ont la caractéristique de se polariser électriquement sous l’action d’une contrainte mécanique et réciproquement de se déformer lorsqu’on leur applique un champ électrique. Il y a l'effet direct et l'effet indirect, les deux sont indissociables.
- Effet piézoélectrique direct : une action mécanique induit une tension électrique.
- Effet piézoélectrique inverse : une tension électrique induit une action mécanique.
Un cristal piézoélectrique est ferroélectrique s'il garde son moment magnétique après application d'un champ électrique. Très peu de matériaux sont ferroélectriques.
Structure
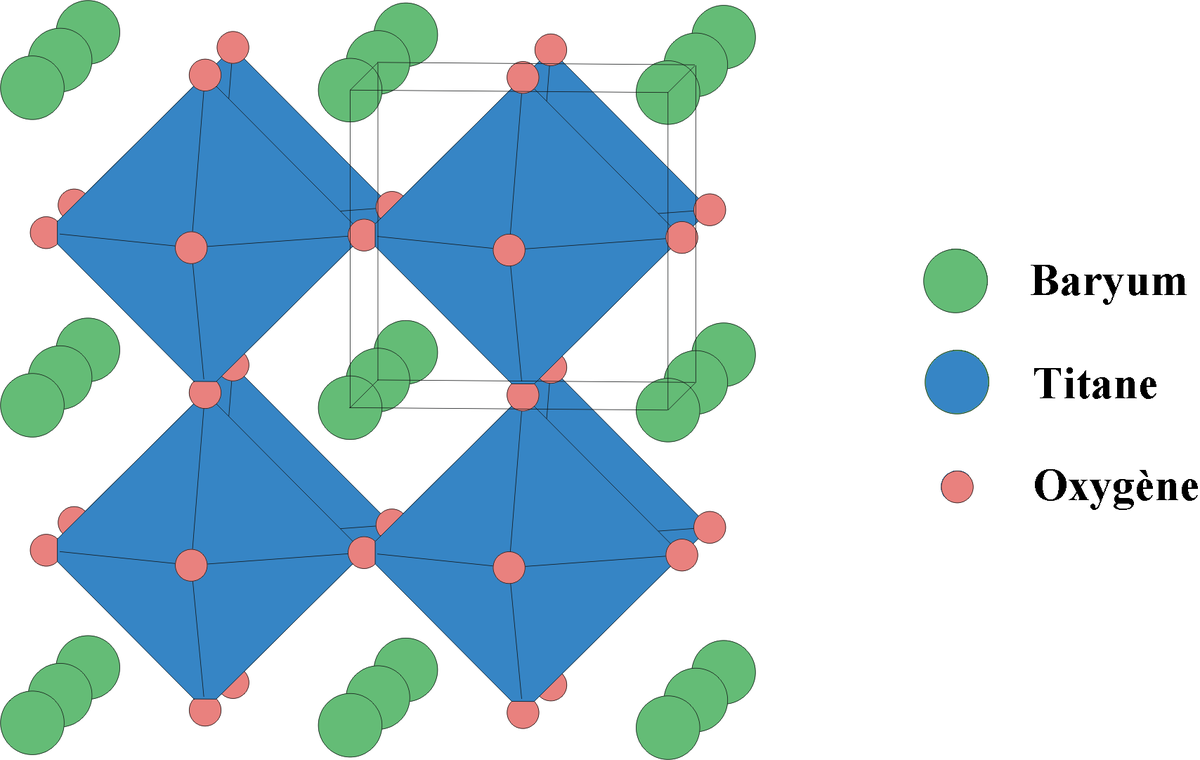
La structure la plus commune des oxydes technologiques à propriétés piézoélectriques est un réseau cristallin orthorhombique formé par des octaèdres d'anions à l'intérieur desquels est emprisonné un cation relativement petit ; 8 de ces octaèdres forment un cube possédant une lacune au centre de laquelle est emprisonné un autre cation relativement grand. Ce type de structure s'appelle : pérovskite. Un exemple est BaTiO dont la structure cristalline est illustrée ci contre.
Origine des propriétés piézoélectriques
Sans déformation, la structure pérovskite ne possède pas de moment électrique car les anions et les cations sont disposés de manière symétrique, les cations sont au centre de leurs sites. Lorsque le réseau est déformé, par pression mécanique par exemple, les cations des lacunes octaèdriques sont décentrés, ce qui induit un moment électrique et donc une tension.
Applications
Les oxydes technologiques piézoélectriques sont utilisés dans des capteurs (de pression, de température, microphones, microbalances...) dans des actionneurs ou moteurs (microscopie à force atomique, microscopie à effet tunnel, optique adaptative en astronomie, autofocus dans les appareils photographiques, têtes d'écriture des imprimantes à jet d'encre...).
Les oxydes technologiques ferroélectriques sont utilisés pour le stockage de l'information.
Oxydes à propriétés électriques
Les oxydes technologiques diélectriques servant comme isolants électriques par exemple.
Oxydes à propriétés optiques
Deux grands types : photocatalyseurs (ex : TiO2) et cristaux photoniques.
Structure
Origine des propriétés optiques
Applications
- Photocatalyseurs : utilisés pour la catalyse en dépollution. Par exemple une couche de TiO2 peut être déposée sur les bâtiments vitrés pour éviter la salissure car il est très oxydant, ou sur un miroir pour éviter l'effet de buée car il a un très bon mouillage par l'eau.
- Cristaux photoniques : ils permettent de créer un gradient d'indice de réfraction.