Liaison halogène - Définition
La liste des auteurs de cet article est disponible ici.
Mise en évidence
Les techniques spectroscopiques, la diffraction des rayons X (DRX), et les calculs théoriques ont permis de mieux comprendre la nature et les mécanismes des interactions halogènes.
par la DRX
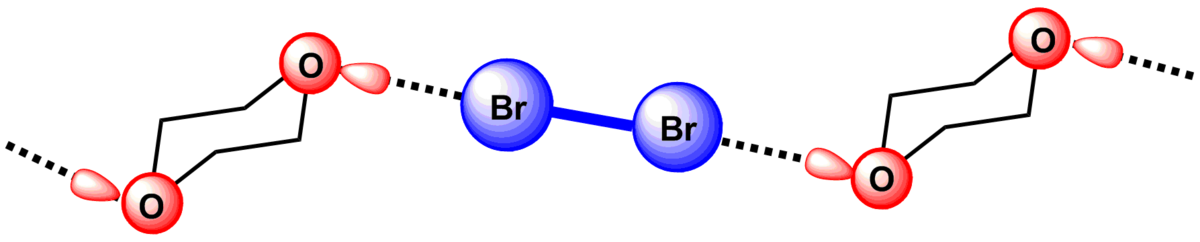
La première preuve cristallographique de la formation de la liaison halogène a été apporté Hassel en 1954. Il a pu élucider la structure de la dibromo-1,4-dioxanate par diffraction des rayons X. Il a ainsi montré que la cohésion de la structure du cristal est assurée par des liaisons halogènes entre le brome et l'oxygène. La présence d'une interaction entre le brome et l'oxygène induit une diminution de la distance O-Br dans le cristal (2.71 Å) qui est de ~20% inférieure à la somme des rayons de van der Waals de l'oxygène et du brome(3.35 Å). Un alingation des atomes participant à la liaison halogène est aussi constaté, en effet l'angle entre les liaisons O-Br et Br-Br est proche de 180 °. Ceci a permis à Hassel de conclure que les atomes d'halogènes sont directement liés au pair d'électron n du donneur et la direction de la liaison coïncide avec les axes des orbitales des doublets libres dans les composés donneurs.
par les calculs théoriques
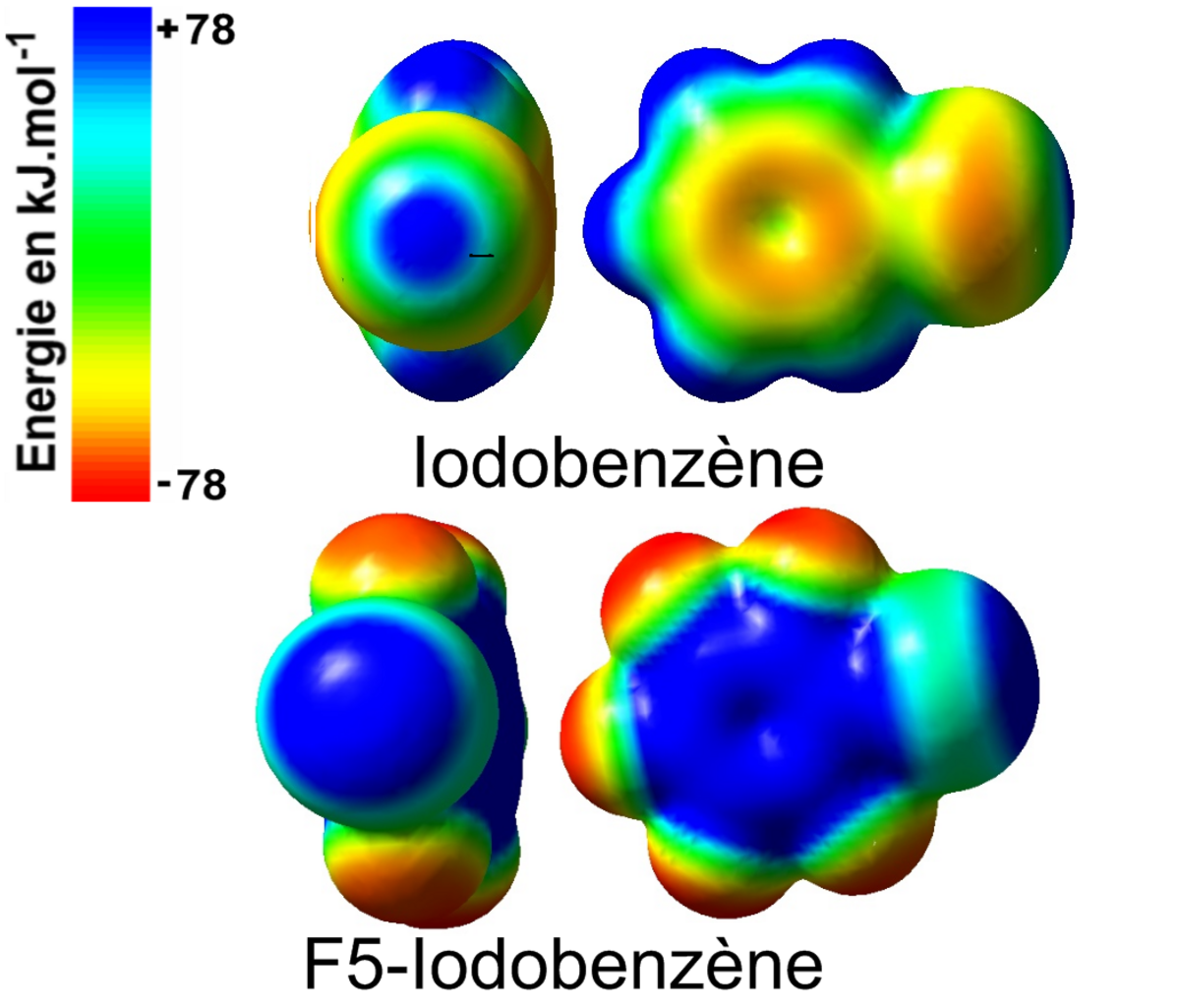
Les calculs théoriques ab-initio permettent d'accéder à de nombreux paramètres électroniques au sein des édifices moléculaires halogénées tels que les charges partielles des atomes, la densité électronique, les distances interatomiques, la polarisabilité, etc. En effet, l'étude de la répartition de la densité électronique et les surfaces de potentiels électrostatiques des dérivés halogénés montrent l'existence d'une zone chargée positivement sur à la surface des halogènes fortement polarisable tels que l'iode (I) ou le brome (Br). Cette zone est appelé trou σ (sigma). L'apparition du trou σ peut être corréler avec l'effet inductif attracteur qu'exerce les atomes ou les groupements d'atomes sur le nuage électronique de l'halogène en question. Ainsi, par exemple, l'étude de distribution de la densité électronique à la surface de l'iodobenzène et du pentafluoroiodobenzène en se basant sur la théorie de la perturbation de Møller-Plesset du second ordre (MP2) suivie par la cartographie de la répartition de la densité à la surface de ces molécules (surface de van der Waals ~ 0.002e/Å2) révèle une zone centrée autour de l'axe de la liaison C-I où l'iode est polarisé positivement (zone bleu) et le noyau aromatique à une forte densité électronique ainsi que et les atomes de fluor (zone rouge). L'augmentation de l'effet attracteur par la substitution des hydrogènes par des fluors accentue et augmente la taille du trou σ.
Politlzer et coll. ont montré que l'établissement de liaisons halogènes est intimement lié à la présence des trous σ à la surface des halogènes. La taille du trou σ est calculée en considérant la force de répulsion électrostatique obtenue entre la zone chargée positivement et un charge positive entière fictive. Elle est exprimée en kJ/mol.
par spectroscopie IR et RMN
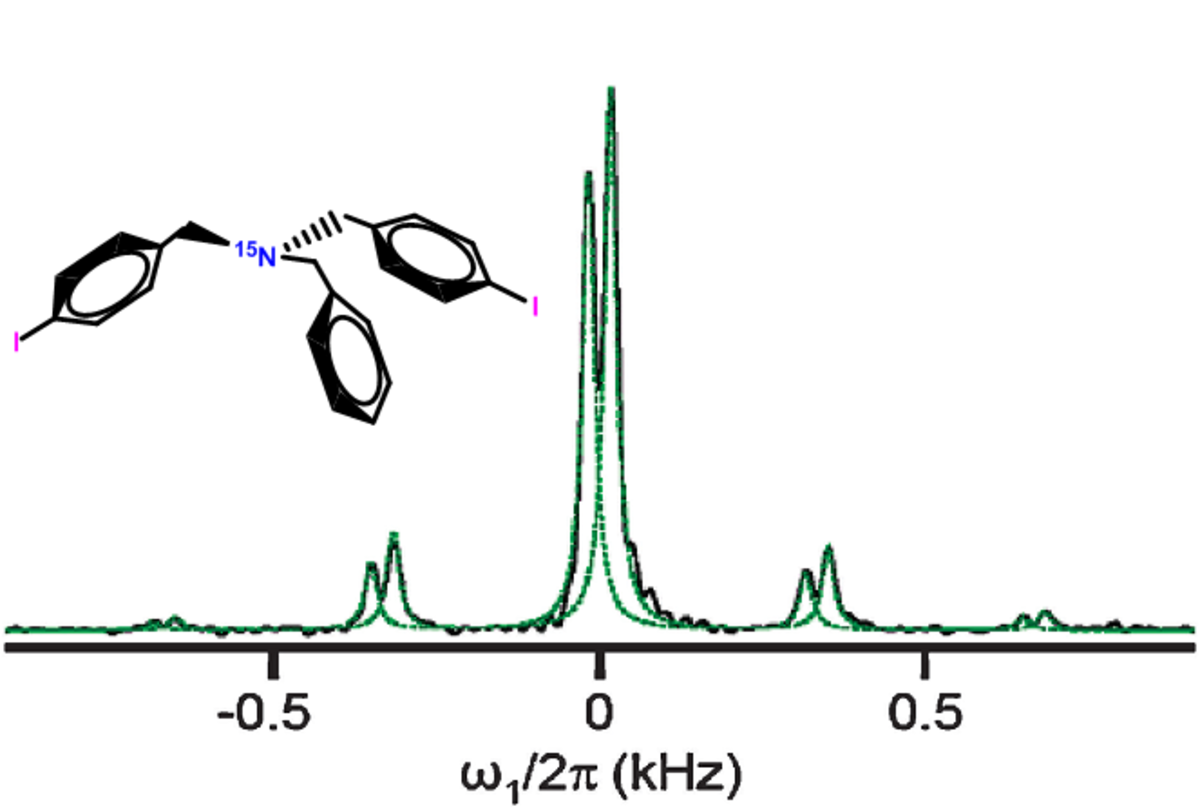
Les études spectroscopiques notamment par la spectroscopie de rotation, la spectroscpie microonde à transformée de Fourier, la spectroscopie infrarouge à transformée de Fourier (FTIR), etc. ont fourni un bon nombre de preuves supplémentaires de la formation des liaisons halogènes. Par exemple, la spectroscopie FTIR a permis de voir la présence des interactions XB à travers un léger changement de la fréquence de vibration des liaisons covalentes C-X. Plus récemment, la RMN de l'azote 15 a été exploitée avec succès afin de mettre en évidence la présence de liaisons halogènes dans une molécule enrichie à l'azote N15 et contenant deux atomes d'iode. Ainsi, la CP-MAS RMN (la RMN de l'état solide à polarisation croisée) a montré la présence de deux signaux relatifs à deux liaisons halogènes au sein du solide du fait que l'azote N15 interagit avec deux iodes situés dans deux positions cristallographiques différentes.