Mitscherlichite - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| | |||
|---|---|---|---|
| Formule brute | K2CuCl4·2H2O | ||
| Numéro CAS | |||
| | |||
| Masse formulaire | 319,59 g/mol | ||
| Couleur | bleu - vert | ||
| Classe cristalline et groupe d'espace | P4/mnm | ||
| Système cristallin | tétragonal | ||
| Échelle de Mohs | 2,5 | ||
| Éclat | vitreux | ||
| | |||
| Indice de réfraction | de 1,60 à 1,64 | ||
| Transparence | transparent | ||
| | |||
| Densité | 2,42 | ||
| Solubilité | se dissout dans l'eau | ||
| | |||
| Radioactivité | aucune | ||
| | |||
La mitscherlichite est un minéral de formule K2CuCl4·2H2O. Elle a été nommée en hommage à Eilhard Mitscherlich.
Il est possible de substituer le potassium par du rubidium ou de l'ammonium sans grand changement de la structure cristalline. Ces isomorphes se distinguent légèrement par leur couleur tirant plus ou moins vers le vert.
Gisements
Découverte en 1925 dans le Vésuve en Italie par Zambonini et Carobbi.
Structure cristalline
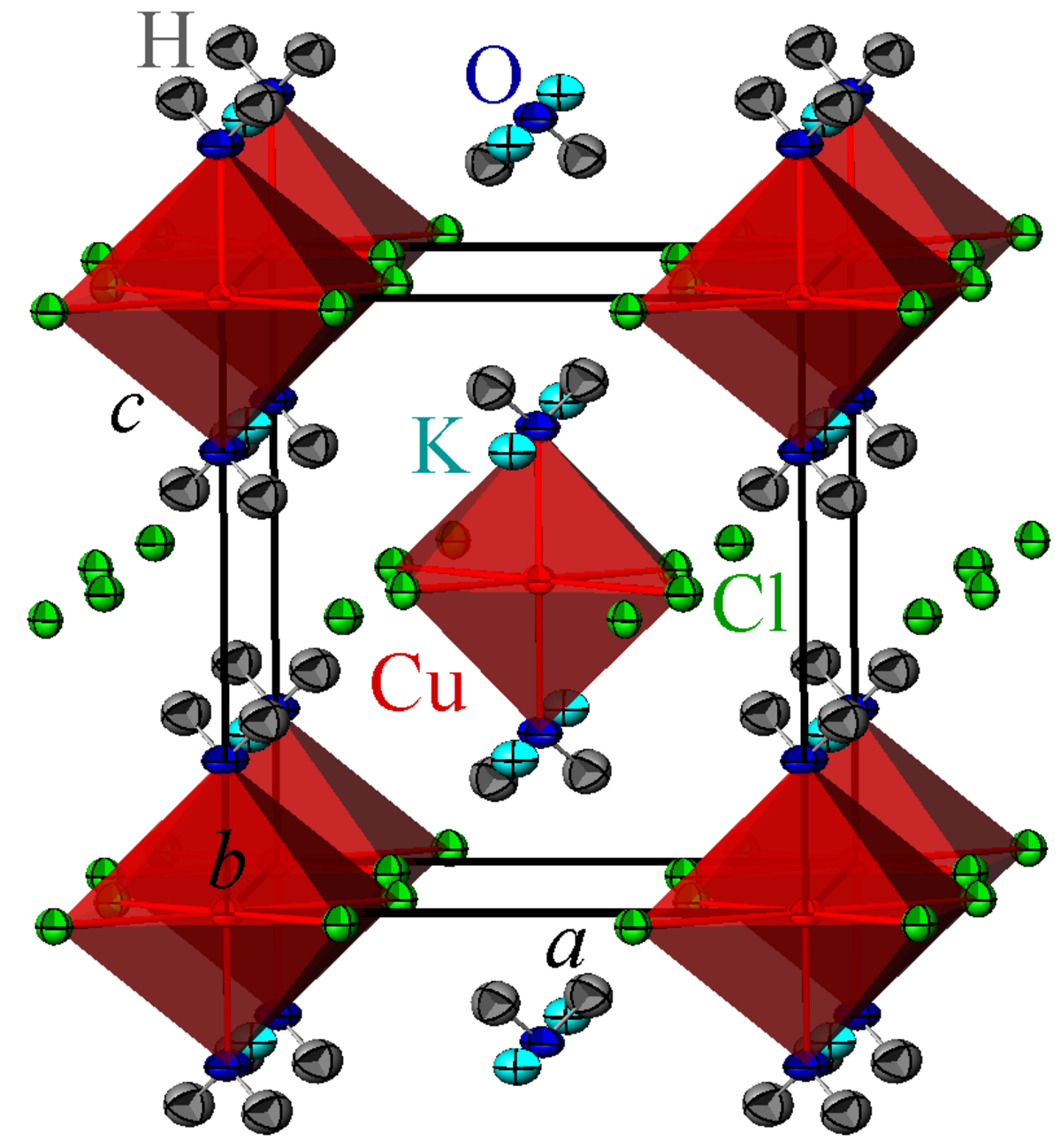
La mitscherlichite cristallise dans le groupe d'espace quadratique P42/mnm (Z = 2) avec les paramètres de maille à température ambiante a = 7,48 Å et c = 7,94 Å.
Les ions K+ (Rb+, NH4+) ont une coordination cubique de chlore. Les ions Cu2+ sont entourés par quatre chlores et deux molécules d'eau dans une coordination octaédrique déformée (4+2).
Les octaèdres CuCl4(H2O)2 sont isolés les uns des autres par les cubes KCl8.
Il est à noter que les atomes d'hydrogène des molécules d'eau ne sont pas désordonnés dans la structure.
Synthèse
La mitscherlichite se laisse facilement synthétiser par évaporation à partir des sels KCl et CuCl2·2H2O en solution aqueuse à température ambiante.
Propriétés physiques
Au-dessus de la température ambiante (à partir d'environ 50 °C), la mitscherlichite perd ses molécules d'eau et se décompose en A2CuCl4 (A = K, NH4, Rb) + vapeur d'eau. Ce phénomène de déshydratation se produit aussi sous atmosphère sèche à température ambiante. À température ambiante, A2CuCl4 est hygroscopique et absorbe l'humidité de l'air pour se transformer en mitscherlichite. Il est facile de distinguer visuellement entre les phases hydratée et déshydratée : la première a une couleur bleu-vert alors que la deuxième est rouge sombre tirant vers le brun.
Au-dessous de -272,27 °C, K2CuCl4·2H2O devient ferromagnétique (cette température de Curie varie légèrement mais reste dans le même ordre de grandeur pour les autres isomorphes).