Monoxyde d'azote - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Monoxyde d'azote | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Code ATC | R07 | ||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | gaz comprime incolore. | ||
| Propriétés chimiques | |||
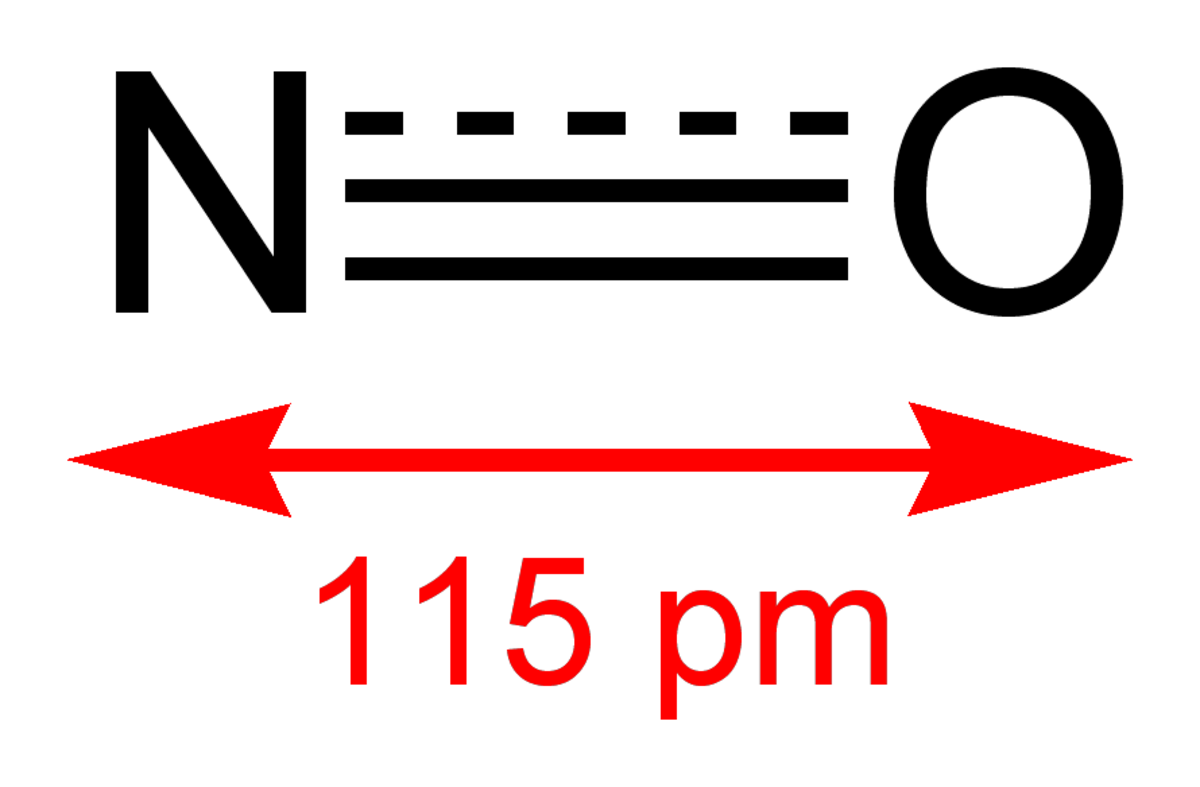
| Formule brute | NO | ||
| Masse molaire | 30,0061 ± 0,0005 g·mol-1 | ||
| Moment dipolaire | 0,15872 D | ||
| Propriétés physiques | |||
| T° fusion | -163,6 °C | ||
| T° ébullition | -151,8 °C | ||
| Solubilité | dans l'eau à 0 °C : 7.4 ml/100 ml | ||
| Masse volumique | 1,3 kg·l-1 (liquide) | ||
| Pression de vapeur saturante | |||
| Point critique | 65,8 bar, -93,35 °C | ||
| Thermochimie | |||
| S0 | 211 J/Mol·K | ||
| ΔH0 | 90,29 kJ·mol-1 | ||
| ΔH0 | 87,7 kJ/Mol | ||
| ΔH° | 13,83 kJ·mol-1 (1 atm, -151,74 °C) | ||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,26438 ± 0,00005 eV (gaz) | ||
| Précautions | |||
| | |||
| |||
| | |||




| |||
| Inhalation | Dangereuse, peut conduire à la mort | ||
| Peau | Irritant | ||
| Yeux | Peut causer des irritations | ||
| Ingestion | Utilisé à des fins thérapeutiques, mais présente des effets indésirables et est dangereux en surdosage | ||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,29 ppm haut : 0,97 ppm | ||
| | |||
Le monoxyde d'azote, oxyde azotique, oxyde nitrique ou NO est un composé chimique formé d'un atome d'oxygène et d'un atome d'azote. C'est un gaz dans les conditions normales de pression et de température. C'est un important neurotransmetteur chez les mammifères et le seul neurotransmetteur gazeux connu.
Le monoxyde d'azote (NO), ne doit pas être confondu avec d'autres oxydes d'azote, tel le monoxyde de diazote N2O, que l'on appelle « gaz hilarant », et qui est un anesthésique général, ou encore tel le dioxyde d'azote NO2, gaz rouge-brun extrêmement irritant et nocif, qui se forme par oxydation rapide de NO par l'oxygène de l'air.
Sa grande réactivité vis-à-vis des composés radicalaires comme l'oxygène moléculaire - qui est un biradical - ou l'anion superoxyde est due au fait qu'il est lui-même un composé radicalaire - son spin électronique total vaut 1/2. En milieu biologique, son temps de demi-vie est estimé entre 1 et 5 secondes, voire 30 secondes. Les peroxynitrites obtenus sont de puissants agents oxydants et nitrants.
Production et effets environnementaux
À haute température, le diazote et le dioxygène réagissent pour donner le monoxyde d'azote, par exemple sous l'effet de la foudre. L'activité humaine a radicalement modifié la production de monoxyde d'azote, qui se forme dans les chambres de combustion des moteurs à explosion. Un des buts des pots d'échappement catalytiques est d'inverser cette réaction.

















































