Nitrite de méthyle - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Nitrite de méthyle | |||
|---|---|---|---|
| |||
| Général | |||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | gaz incolore | ||
| Propriétés chimiques | |||
| Formule brute | CH3NO2 | ||
| Masse molaire | 61,04 ± 0,0018 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | -40,2 °C | ||
| T° ébullition | -6,42 °C | ||
| Solubilité | très peu soluble dans l'eau | ||
| Masse volumique | 0,991 g·cm-3 à 15 °C | ||
| Limites d’explosivité dans l’air | 5,3 Vol.-% (137 g·m-3) - 100 Vol.-% | ||
| Pression de vapeur saturante | > 1 bar à 20 °C | ||
| Précautions | |||
| | |||
| |||
| | |||
| |||
| | |||
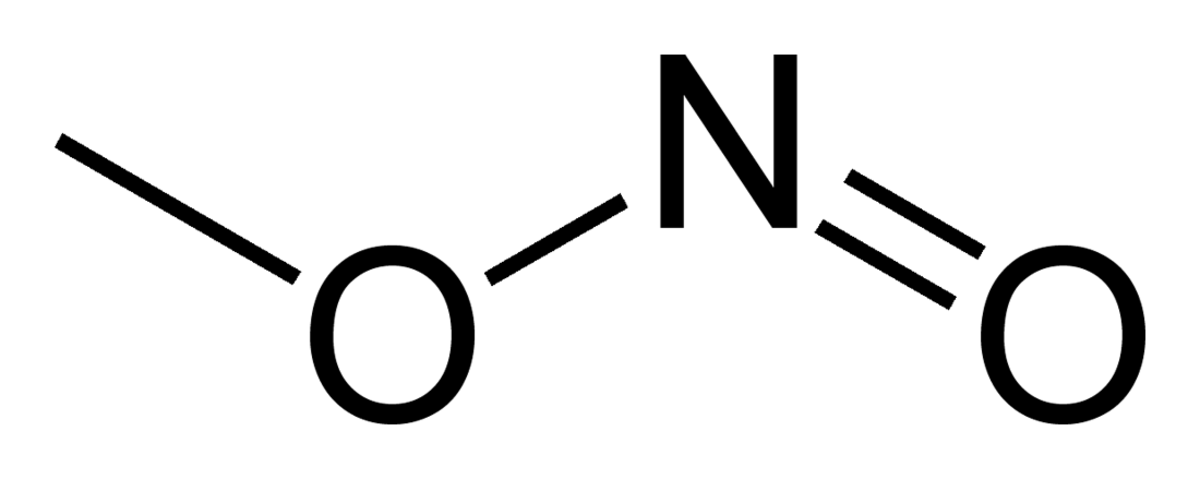
Le nitrite de méthyle est un composé organique, le plus simple de la famille des nitrites d'alkyle. C'est un gaz incolore particulièrement instable, toxique et inflammable.
Structure
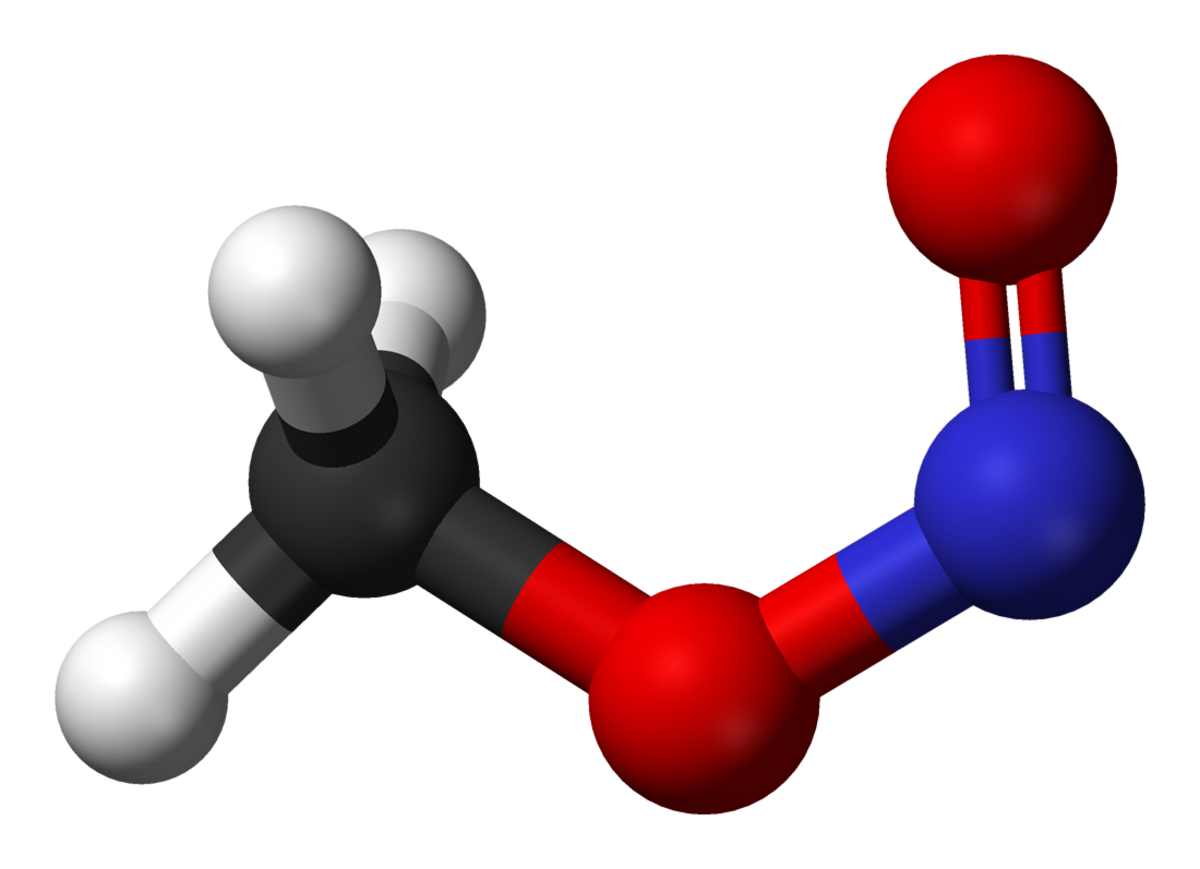
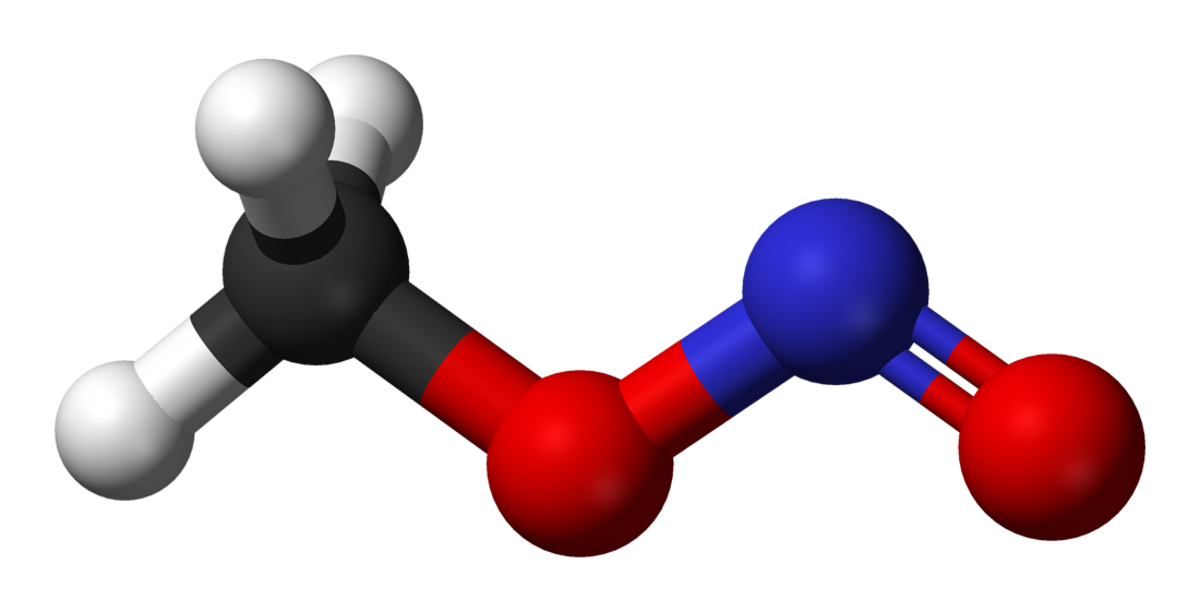
A température ambiante, le nitrite de méthyle existe sous la forme d'un mélange de conformères cis et trans. La forme cis est plus stable de 3.13 kJ mol−1 que la forme trans, avec une barrière d'énergie de rotation de 45.3 kJ mol−1.
| 
|
| | |
Synthèses
Le nitrite de méthyle peut être préparé par réaction entre le nitrite d'argent et l'iodométhane. L'un des doublets libres de l'oxygène de l'ion nitrite va attaquer le groupe méthyle (—CH3), libérant de l'iode en solution. Con trariement au nitrite d'argent, l'iodure d'argent est particulièrement insoluble dasn l'eau, et forme donc un dépôt solide. À noter cependant que l'azote du groupe nitrite est bien plus nucléophiles que l'oxygène, et donc la plupart des ions nitrites vont réagir par un méacanisme de type SN2 pour produire du nitrométhane. Par exemple, si on faisait réagir du nitrite de sodium ou du nitrite de potassium avec l'iodométhane, on obtiendrait quasiment uniquement du nitrométhane, et très peu de nitrite de méthane. L'utilisation de nitrite d'argent permet au contraire de stabiliser la formation d'un intermédiaire de type carbocation qui favorise la formation de nitrite de méthyle, faisant grimpet le rendement, même si du nitrométhane est toujours produit.
Le nitrite de méthyle est aussi produit par la combustion de l'essence sans plomb, et pourrait être la cause du déclin d'insectes, ainsi que du moineau domestique et d'autre Passeri en Europe.