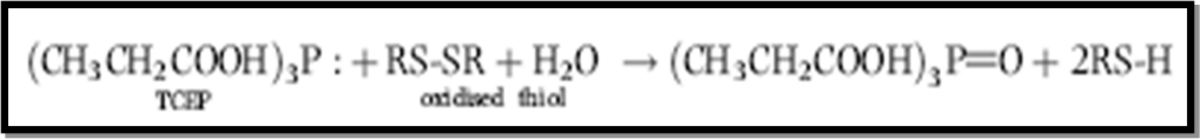Phytochélatine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
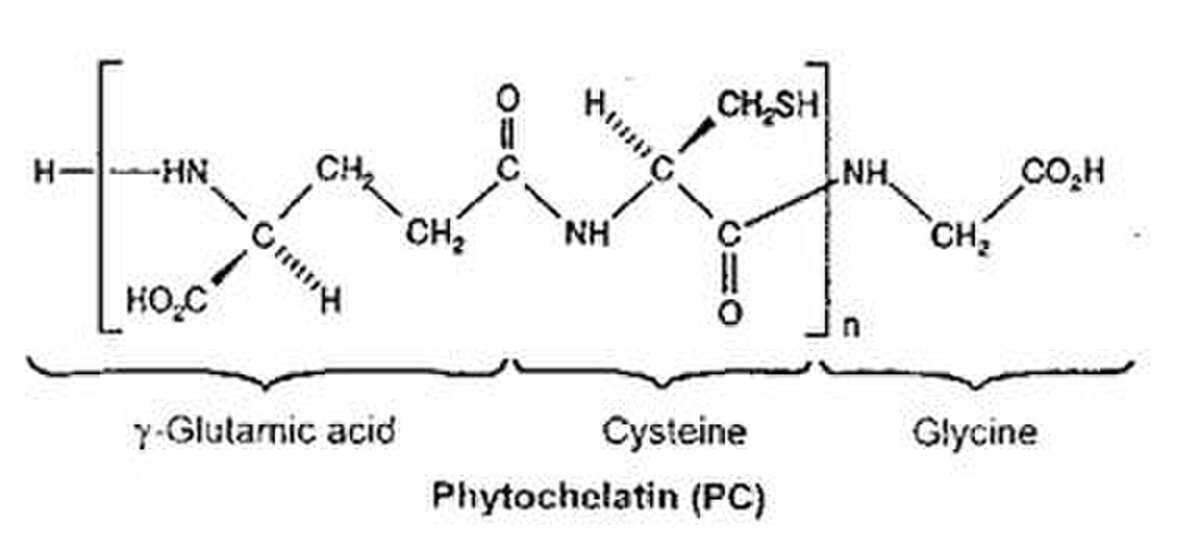
Les phytochélatines (PCs) sont des polypeptides de poids moléculaire compris entre 1,5 et 4 kDa dont leur chaîne principale possède une répétition du dipeptide γ-Glu-Cys suivi par le terminal Gly donc, la structure de base des phytochélatines est (γ-Glu-Cys)n-Gly où n varie entre deux et onze. Elle se classe, avec la métallothionéine (MT) et certains acides organiques, parmi les agents de chélation naturels. Les phytochélatines sont responsables de la tolérance des plantes aux ions métalliques notamment au cadmium (Cd2+). Les phytochélatines ont été isolés pour la première fois en 1985 à partir de cellules des cultures en suspension.
Synthèse des phytochélatines
La synthèse des phytochélatines est réalisée à partir d’une enzyme, la gamma-glutamylcystéine dipeptidyl transpeptidase, communément appelée la phytochélatine synthase (PCS). Cette enzyme utilise le glutathion (GSH), qui fournit des groupements γ-Glu-Cys-Gly, afin de synthétiser la phytochélatine. Ci-joint, un résumé de cette synthèse :
PCS γ-Glu-Cys-Gly + (γ-Glu-Cys)n-Gly -----> (γ-Glu-Cys)n+1-Gly + Gly (GSH) (phytochélatine)
Une quantité importante d’ions métalliques changent la conformation de la PCS en une conformation la rendant active. L’expression de cette enzyme est régulée selon la toxicité métallique du milieu auquel l’organisme est exposé. Les métaux qui induisent la synthèse de phytochélatines sont des métaux lourds tels que Cd, Ag, Pb, As, Cu.
La PCS a été identifiée et caractérisée pour la première fois en 1999. La reconnaissance d’ions métalliques se fait dans la partie C-terminale des phytochélatines alors que la partie N-terminal agit comme un domaine catalytique. La chélation se fait à partir de liaisons formées entre les unités sulfures de la cystéine et l’ion métallique comme nous indique la figure suivante :
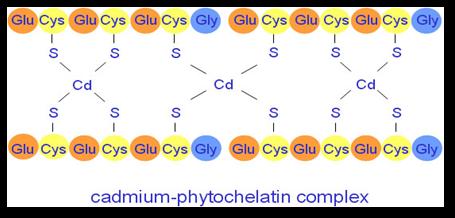
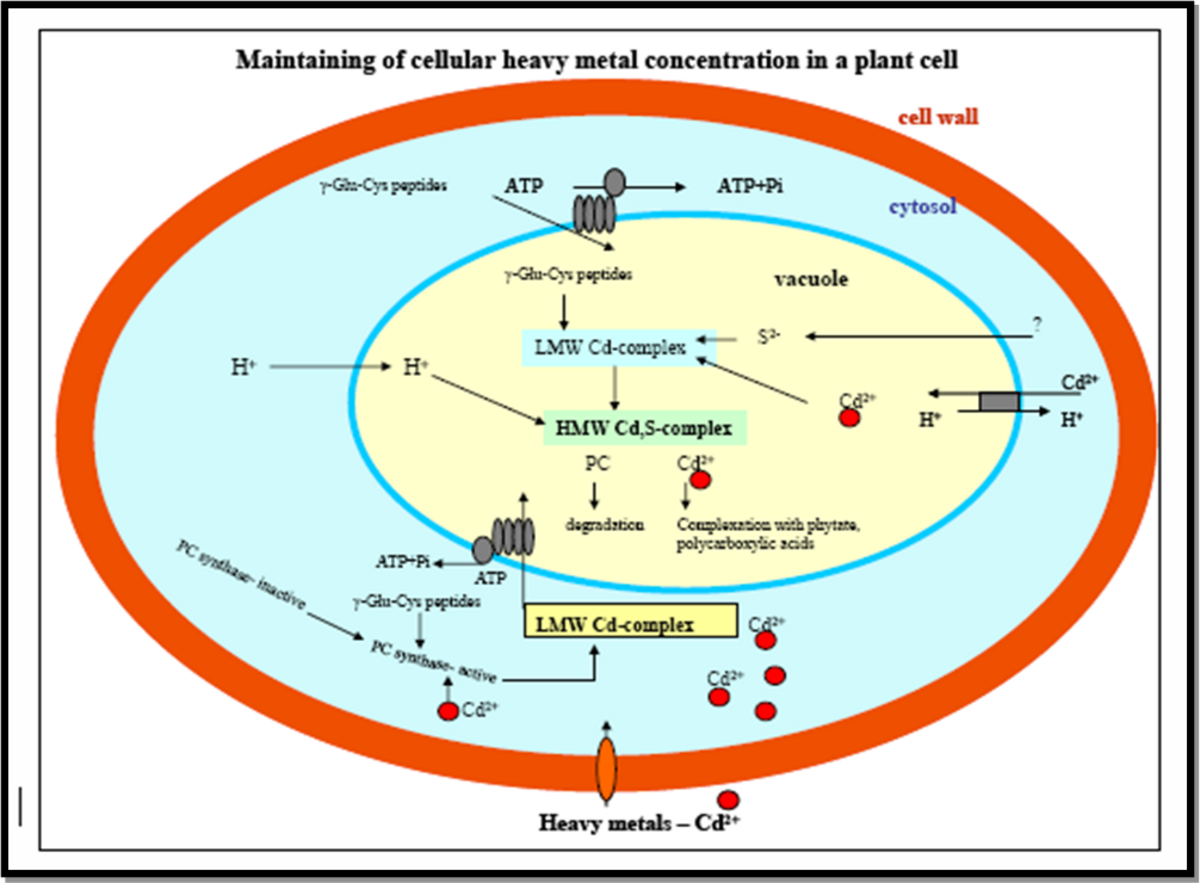
La phytochélatine (PC) possède des domaines de reconnaissances qui sont reconnus par les vacuoles d’une cellule. Ainsi, le complexe PC-Ion métallique est capté et transporté dans la vacuole par le biais d’un transport actif utilisant un transporteur spécifique aux phytochélatines et l’ATP. Dans la vacuole, les phytochélatines sont dégradés en acides aminés et les ions métalliques sont liés à des acides organiques. Ainsi, en empêchant l’excès d’ions métalliques à circuler librement dans le cytoplasme par formation de complexes avec ces derniers et en s’engageant à leur séquestration vacuolaire, les phytochélatines forment un atout indispensable quant à la tolérance aux ions métalliques.
Détection des phytochélatines dans les phytoplanctons des eaux naturelles
Pour faire l´analyse des phytochélatines, on doit passer par les étapes suivantes : Échantillonnage, filtration de l´échantillon, extraction des thiols, réduction des groupements thiols, dérivatization des thiols, analyse des dérivées thiols par HPLC.
- Échantillonnage
Doit se faire dans avec des bouteilles (2 - 4L) en polycarbonate, lavées à l´acide (1 M HCl) puis rincées au minimum trois fois par l´eau Milli-Q. le prélèvement de l’échantillon se fait à 0.3 m de profondeur d’ une eau naturelle.
- Filtration de l´échantillon
Une filtration sous vide doit être nécessaire avec une pression (<5psi) et cela en utilisant des filtres en nitrocellulose 47mm de diamètre dont la taille des pores est de 0.8µM. ensuite ces filtres (contenant les phytoplanctons) seront placés dans des microtubes.
- Extraction des thiols
L’extraction se fait par un ajout (aux microtubes) de 1.2 mL HCl 0.1M (dénature les enzymes capables de dégrader les groupements thiols des peptides) contenant 5mM DTPA (diminue l´oxydation des groupements thiols par le métal), ensuite placé dans un ultrasonicateur (0°C ; 5 minutes), puis les cellules extraites seront centrifugées (20min; 13000g; 4°C).
- Réduction des groupements thiols
Le TCEP est le réactif réducteur utilisé, une addition au surnageant (250µL) un volume de 25µL de TCEP 20mM (préparé dans 200mM HEPES/ 5mM DTPA (pH=8.2)) peut réduire les thiols oxydés selon la réaction suivante :
- Dérivatisation des thiols
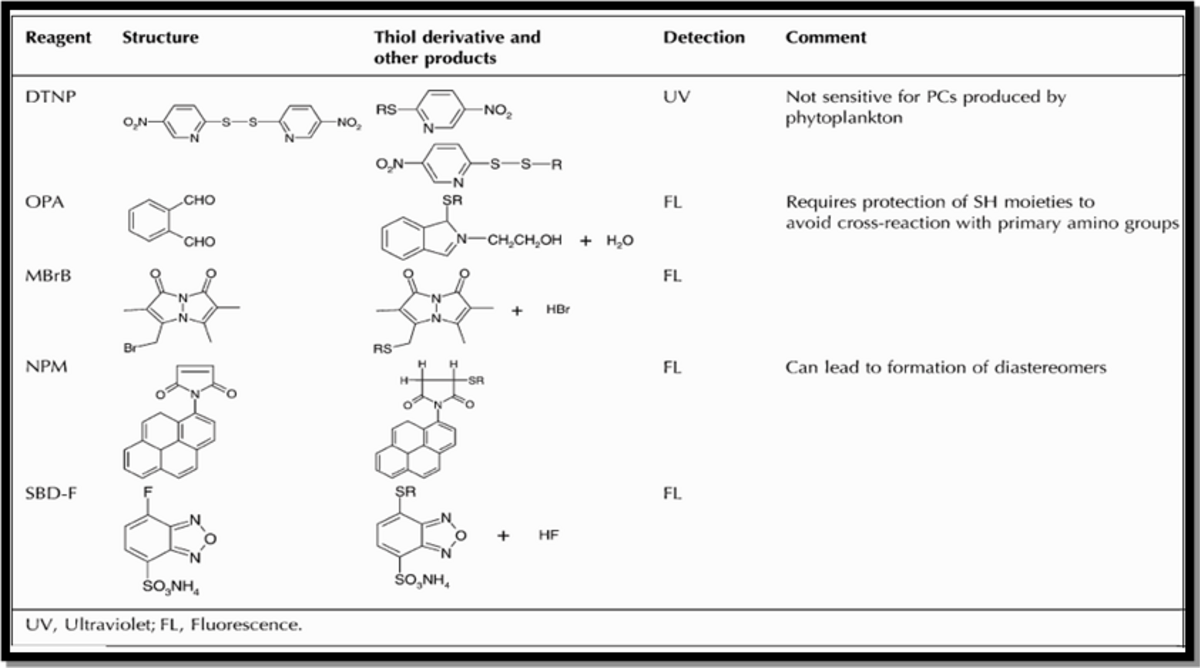
Plusieurs réactifs peuvent être utilisés pour la dérivatisation des thiols tel que le DTNP (n’est pas sensible pour la détection des PCs dans les phytoplanctons), OPA (stable pour une courte durée), NPM (formation des diastérioisomères), SBD-F et MBrB.
Seuls les SBD-F et MBrB sont utilisés pour la dérivatisation des thiols des phytoplanctons. Dans cette expérience ils ont choisi le MBrB (1 mM dans l’acétonitrile), après 15 minutes on arrête la réaction en ajoutant MSA (0.1M) et l’échantillon sera mis dans le froid (4ºC) et à l’abri de la lumière.