Rayon atomique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Le rayon atomique d'un élément chimique est une mesure de la taille de ses atomes, d'habitude la distance moyenne entre le noyau et la frontière du nuage électronique qui l'entoure. Comme cette frontière n'est pas une entité physique bien définie, il y a plusieurs définitions non équivalentes du rayon atomique.
Selon la définition, le terme peut s'appliquer seulement sur des atomes isolés, ou aussi sur des atomes dans de la matière condensée, une liaison covalente dans une molécule ou dans des états ionisés et excités. Sa valeur peut être obtenue par des mesures expérimentales ou calculés à partir de modèles théoriques. Avec certaines définitions, la valeur du rayon atomique peut dépendre de l'état atomique et de son environnement
Les atomes peuvent souvent être modélisés comme étant des sphères. C'est une approximation un peu grossière, mais qui peut fournir des explications et des prédictions pour de nombreux phénomènes comme la densité des fluides et des solides, la diffusion de fluides dans un tamis moléculaire, l'arrangement d'atomes et d'ions dans les cristaux et la taille et forme des molécules.
Néanmoins le concept de rayon atomique est difficile à définir parce que les électrons n'ont pas d'orbite bien définie, ni de taille précise. Leur position doit ainsi être décrite à l'aide de probabilités de distribution qui diminuent graduellement en s'éloignant du noyau, sans s'annuler de manière brusque. De plus dans la matière condensée et les molécules, les nuages électroniques des atomes se chevauchent souvent et certains électrons peuvent être délocalisées sur deux atomes ou plus.
Malgré ces difficultés conceptuelles, la plupart des définitions, pour des atomes isolés, donnent un rayon compris entre 30 et 300 pm (de 0.3 à 3 angströms) Le rayon atomique est donc 10000 fois plus grand que le noyau atomique mais inférieur à un millième de la longueur d'onde du visible.
Les rayons atomiques varient de manière prévisible lorsqu'on se déplace dans le tableau périodique. Par exemple, les rayons diminuent en général le long d'une période (rangée) de la table depuis les alcalins jusqu'aux gaz nobles; et augmentent lorsqu'on descend une colonne.
Définitions et méthodes de calcul du rayon atomique
Dans un solide
On définit le rayon atomique comme la moitié de la distance qui sépare les noyaux de deux atomes contigus dans un solide ou dans une molécule. La formule pour déterminer le rayon atomique est :
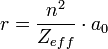
Où n est le nombre quantique principal de la couche de valence, Zeff désigne la charge effective du noyau et a0 le rayon de l’atome de Bohr qui sert ici de référence pour le calcul et qui équivaut à 0,0529 nm.
Dans des atomes impliqués dans une liaison chimique
Si une liaison covalente est formée entre deux non-métaux, il sera question d’un type spécifique de rayon atomique nommé rayon covalent. Si une liaison métallique est formée entre deux métaux, il sera question d’un type spécifique de rayon atomique nommé rayon métallique.
Cette longueur, mesurée à l'aide d'un diffractomètre à rayons X, permet de déterminer de manière approximative la taille d'un atome, même si les nuages d'électrons des deux atomes se mélangent.
Évolutions au sein du tableau périodique
Dans un tableau périodique, plus on va vers la droite sur une même période, plus le rayon atomique est petit. Cette propriété périodique est directement reliée à l’augmentation de la charge effective car, lors du déplacement de gauche vers la droite sur une période, le nombre de protons et d’électrons de valence augmentent, mais l’effet d’écran causé par les électrons internes reste sensiblement le même. Cette croissance traduit une augmentation de l’attraction entre le noyau et les électrons de valence et donc à une diminution de la distance entre les noyaux des deux atomes.
Plus on va vers le bas sur une même colonne, plus le rayon atomique est grand. L’explication de cette tendance périodique est relativement simple : le nombre quantique principal n, porté au carré, augmente plus rapidement que Zeff dans la formule du rayon atomique. En termes physiques, ceci signifie que de haut en bas dans une famille, le nombre de protons et le nombre d’électrons internes augmentent, mais le nombre d’électrons de valence reste constant. L’effet d’écran est donc de plus en plus important et les électrons de valences sont moins fortement retenus par le noyau. L’augmentation du rayon atomique est alors causée par une « dilatation du nuage électronique ».
Le tableau suivant donne les valeurs en Ångström publiées par J. C. Slater , avec une approximation de 0.12 Å :
| H 0,25 | He | ||||||||||||||||
| Li 1,45 | Be 1,05 | B 0,85 | C 0,7 | N 0,65 | O 0,6 | F 0,5 | Ne | ||||||||||
| Na 1,8 | Mg 1,5 | Al 1,25 | Si 1,1 | P 1 | S 1 | Cl 1 | Ar | ||||||||||
| K 2,2 | Ca 1,8 | Sc 1,6 | Ti 1,4 | V 1,35 | Cr 1,4 | Mn 1,4 | Fe 1,4 | Co 1,35 | Ni 1,35 | Cu 1,35 | Zn 1,35 | Ga 1,3 | Ge 1,25 | As 1,15 | Se 1,15 | Br 1,15 | Kr |
| Rb 2,35 | Sr 2 | Y 1,8 | Zr 1,55 | Nb 1,45 | Mo 1,45 | Tc 1,35 | Ru 1,3 | Rh 1,35 | Pd 1,4 | Ag 1,6 | Cd 1,55 | In 1,55 | Sn 1,45 | Sb 1,45 | Te 1,4 | I 1,4 | Xe |
| Cs 2,6 | Ba 2,15 | * | Hf 1,55 | Ta 1,45 | W 1,35 | Re 1,35 | Os 1,3 | Ir 1,35 | Pt 1,35 | Au 1,35 | Hg 1,5 | Tl 1,9 | Pb 1,8 | Bi 1,6 | Po 1,9 | At | Rn |
| Fr | Ra 2,15 | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| * | La 1,95 | Ce 1,85 | Pr 1,85 | Nd 1,85 | Pm 1,85 | Sm 1,85 | Eu 1,85 | Gd 1,8 | Tb 1,75 | Dy 1,75 | Ho 1,75 | Er 1,75 | Tm 1,75 | Yb 1,75 | Lu 1,75 | ||
| ** | Ac 1,95 | Th 1,8 | Pa 1,8 | U 1,75 | Np 1,75 | Pu 1,75 | Am 1,75 | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||

















































