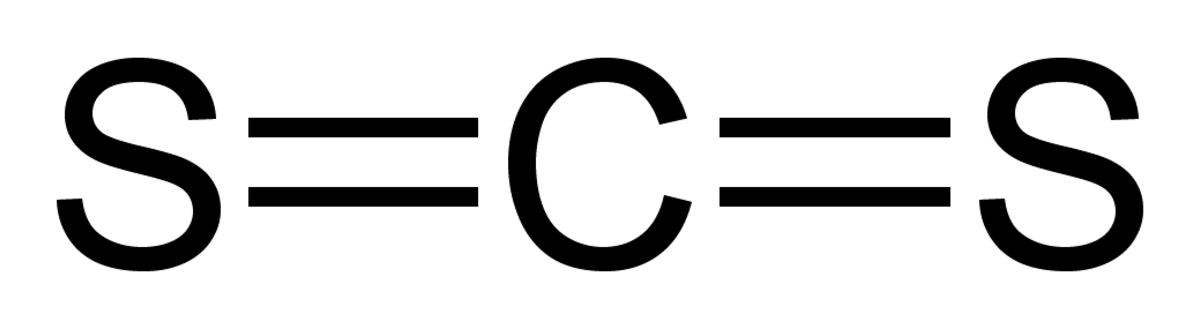Sulfure de carbone - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
Introduction
| Sulfure de carbone | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Anhydride sulfocarbonique Bisulfure de carbone | ||
| No CAS | |||
| No EINECS | |||
| Apparence | liquide incolore, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
| Formule brute | CS2 | ||
| Masse molaire | 76,141 ± 0,011 g·mol-1 | ||
| Moment dipolaire | 0,06 D | ||
| Diamètre moléculaire | 0,453 nm | ||
| Propriétés physiques | |||
| T° fusion | -111 °C | ||
| T° ébullition | 46 °C | ||
| Solubilité | dans l'eau à 20 °C : 2 g·l-1 | ||
| Masse volumique | 1,26 g·cm-3 | ||
| T° d’auto-inflammation | 90 °C | ||
| Point d’éclair | -30 °C (coupelle fermée) | ||
| Limites d’explosivité dans l’air | 1–50 %vol | ||
| Pression de vapeur saturante | à 25 °C : 48 kPa | ||
| Viscosité dynamique | 0,36 mPa·s à 25 °C | ||
| Point critique | 79,0 bar, 278,85 °C | ||
| Conductivité thermique | 0,162 W⋅m-1⋅K-1 à 20 °C | ||
| Conductivité électrique | 78×10-19 Ω-1·cm-1 à 18 °C | ||
| Thermochimie | |||
| S0 | 237,83 J⋅mol-1⋅K-1 | ||
| Cp | 76,45 J⋅mol-1⋅K-1 à 25 °C (liquide) | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,0685 ± 0,0020 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 11, 36/38, 48/23, 62, 63, | |||
| Phrases S : 1/2, 16, 33, 36/37, 45, | |||
| | |||
| |||
| | |||
|
4 3 0 | |||
| | |||


| |||
| | |||

Danger | |||
| Écotoxicologie | |||
| LogP | 1,84 | ||
| Seuil de l’odorat | bas : 0,01 ppm haut : 0,42 ppm | ||
| | |||
Le sulfure de carbone, de formule chimique CS2, est un solvant très toxique, utilisé en chimie pour dissoudre de nombreux composants organiques, ainsi que le soufre, le phosphore blanc, le sélénium, le diiode, le caoutchouc ou les résines et les cires. Il est aussi utilisé comme intermédiaire de synthèse dans la fabrication de nombreux composés organiques soufrés : agents de vulcanisation du caoutchouc, produits pharmaceutiques, produits phytosanitaires (fongicides, insecticides). Au XIXe siècle, il fut utilisé pour lutter contre le phylloxéra de la vigne.